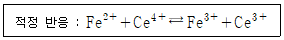위 이미지를 클릭하시면 인터넷으로 바로 문제를 풀어 보실수 있습니다.
(해설, 모의고사, 오답노트, 워드, 컴활, 정보처리 상설검정 프로그램 기능 포함)
전자문제집 CBT란?
종이 문제집이 아닌 인터넷으로 문제를 풀고 자동으로 채점하며 모의고사, 오답 노트, 해설까지 제공하는
무료 기출문제 학습 프로그램으로 실제 상설검정에서 사용하는 OMR 형식의 CBT를 제공합니다.
최신 화학분석기사(구) 필기 기출문제(해설) : [다운로드]
화학분석기사(구) 필기 기출문제(해설) 및 전자문제집 CBT 2019년09월21일| 1. | 주어진 온도에서 N2O4(g) ⇄ 2NO2(g)의 계가 평형상태에 있다. 이때 계의 압력을 증가시킬 때 반응의 변화로 옳은 것은? |
| 1. | 정반응과 역반응의 속도가 함께 빨라져서 변함없다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 89%
| | <문제 해설>
4. 압력을 증가시켰을 경우, 르샤틀리에의 원리에 의해 압력을 감소하려는 방향으로 반응이 진행됨.
따라서 몰수가 적은 역방향으로 진행
[해설작성자 : 단츄즈] |
|
| 2. | 2.5g의 살리실산가 3.1g의 아세트산 무수물을 반응시켰더니, 3.0g의 아스피린을 얻을 수있었다. 아스피린의 이론적 수득량은 약 몇 g 인가? (단, 살리실산의 분자량 : 138.12g/mol, 아세트산무수물의 분자량 : 102.09g/mol, 아스피린의 분자량 : 180.16g/mol 이고, 살리실산과 아세트산무수물은 1:1로 반응하고 반응에서 역반응은 일어나지 않았다고 가정한다.) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 70%
| | <문제 해설>
살리실산 + 아세트산 무수물 -> 아스리핀
2.5/138.12 3.0/102.09, 살리실산이 한계반응물이므로
살리실산의 몰수만큼 아스피린의 몰수가 나오는 것이 이론상 수득률.
0.01810 X 180.16 = 3.2609, 따라서 답은 4번.
[해설작성자 : 지원] |
|
| 3. | 수소 연료전지에서 전기를 생산할 때의 반응식이 다음과 같을 때 10g의 H2와 160g의 O2가 반응하여 생성된 물은 몇 g 인가? |
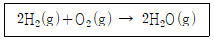
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 86%
| | <문제 해설>
1. 반응식의 계수에 따른 양적관계를 살펴보면, 반응한 수소 몰 수 = 생성된 물의 몰 수.
따라서 10g H2는 5mol 이므로, 생성된 H2O도 5mol 생성되었을 것이고, 질량은 5*18g=90.
[해설작성자 : 단츄즈] |
|
| 4. | 다음 단위체 중 첨가 중합체를 만드는 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 85%
| | <문제 해설>
첨가중합을 만들기 위해선 이중결합 물질이 필요함
[해설작성자 : ㅎㅎ] |
|
| 5. | 납 원자 2.55×1023개의 질량은 약 몇 g인가? (단,납의 원자량은 207.2이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 85%
| | <문제 해설>
2.55*10^23개 *1mol/6.02*10^23개 *207.2g/1mol
[해설작성자 : 화분기니가몬데] |
|
| 6. | 다원자 이온에 대한 명명 중 옳지 않은 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 79%
| | <문제 해설>
3. SO3 2-는 아황산이온.
[해설작성자 : 단츄즈] |
|
| 7. | 카르보닐(corbonyl)기를 가지고 있지 않은 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 69%
| | <문제 해설>
카복실기: R-COO-
카르보닐기 : C=O
[해설작성자 : 은보라] |
|
| 8. | 부탄이 공기 중에서 완전 연소하는 화학반응식은 다음과 같다. ( ) 안에 들어갈 계수들 중 a의 값은 얼마인가? |
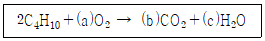
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 89%
| | <문제 해설>
4. b=8, c=10, a=13
[해설작성자 : 단츄즈] |
|
| 9. | 일반적인 화학적 성질에 대한 설명 중 틀린 것은? |
| 1. | 열역학적 개념 중 엔트로피는 특정 물질을 이루고 있는 입자의 무질서한 운동을 나타내는 특성이다. |
| 2. | Albert Eimstein 이 발견한 현상으로, 빛을 금속 표면에 쪼였을 때 전자가 방출되는 현상을 광전효과라 한다. |
| 3. | 기체 상태의 원자에 전자 하나를 더하는 데 필요한 에너지를 이온화 에너지라 한다. |
| 4. | 같은 주기에서 원자의 반지름은 원자번호가 증가할수록 감소한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 84%
| | <문제 해설>
3. 기체 상태의 원자에 전자 하나를 "떼어내는" 데 필요한 에너지를 이온화 에너지라 한다.
[해설작성자 : 단츄즈]
최외각 전자라고 하면 더 좋습니다.
[해설작성자 : 신쫄이 레콜맛] |
|
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 87%
| | <문제 해설>
3. H=1, C=x, O=-2이므로, 2+2x-8=0 따라서 x=+3
[해설작성자 : 단츄즈] |
|
| 11. | 용액의 농도에 대한 설명이 잘못된 것은? |
| 1. | 노르말농도는 용액 1L에 포함된 용질의 그램 당량수로 정의한다. |
| 2. | 몰분율은 그 성분의 몰수를 모든 성분의 전체 몰수로 나눈 것으로 정의한다. |
| 3. | 몰농도는 용액 1L에 포함된 용질의 양을 몰수로 정의한다. |
| 4. | 몰랄농도는 용액 1kg에 포함된 용질의 양을 몰수로 정의한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
몰랄농도는 용매 1Kg에 포함된 용질의 양을 몰수로 정의한다.
[해설작성자 : 다수] |
|
| 12. | 산성비의 발생과 가장 관계가 없는 반응은? |
| 1. | Ca2+(aq)+ CO32-(aq) → CaCO3(s) |
| 3. | N2(g) + O2(g) → 2NO(g) |
| 4. | SO3(g) + H2O(L) → H2SO4(aq) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 88%
| | <문제 해설>
1. 탄산칼슘 생성 반응 (오히려 산성비에 의해 산화됨, 생성은 관련 없음)
[해설작성자 : 단츄즈] |
|
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
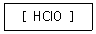
ClO4^- : 과염소산
ClO3^- : 염소산 (기준)
ClO2^- : 아염소산
ClO^- : 하이포아염소산
[해설작성자 : 합격]
염소산 hclo3
아염소산 hclo2
과염소산 hclo4
하이포 염소산 hclo
[해설작성자 : 합격하고싶어요] |
|
| 14. | 어떤 과일 주스의 pH가 4.7이다. 용액의 OH- 이온 농도는 몇 mol/L 인가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
pH = log[1/H] = -log[H],
pH=4.7이면 pOH=14-4.7=9.3 인 것은 알고 있어야한다.
9.3=-log[OH], 상용로그를 풀어주면 [OH]=10^(-9.3)임을 알 수 있다.
[해설작성자 : 죤] |
|
| 15. | 특정 온도에서 기체 혼합물의 평형농도는 H2 0.13M, I2 0.70M, HI2.1M이다. 같은 온도에서 500.00mL 빈 용기에 0.20 mol의 HI를 주입하여 평형에 도달하였다면 평형 혼합물 속의 HI의 농도는 몇 M 인가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 35%
| | <문제 해설>
K = [HI]^2/([H2][I2])
[HI] = 0.20mol/0.5L = 0.40M
H2 + I2 ⇔ 2HI이므로,
2.1^2/(0.13*0.70) = (0.4-2x)^2/x^2
x = 0.045M
따라서, 평형 상태에서의 HI의 몰수는 0.4 - 2*0.045 = 0.31M
[해설작성자 : 조금일하고많이벌자] |
|
| 16. | 돌턴(Dalton)의 원자설에서 설명한 내용이 아닌 것은? |
| 1. | 물질은 더 이상 나눌 수 없는 원자로 이루어져 있다. |
| 2. | 원자가전수의 수는 화학결합에서 중요한 역할을 한다. |
| 4. | 서로 다른 원소의 원자들이 간단한 정수비로 결합하여 화합물을 만든다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
2번은 루이스입니다.
[해설작성자 : 신쫄이 레콜맛] |
|
| 17. | 다음 화학종 가운데 증류수에서 용해도가 가장 큰 화학종은 무엇인가? (단, 각 화학종의 용해도곱상수는 괄호 안의 값으로 가정한다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 78%
| | <문제 해설>
AgCl의 Ksp = [Ag+][Cl-] = 10^-10, 용해도 = 10^-5
AgI의 Ksp = [Ag+][I-] = 10^-16, 용해도 = 10^-8
Ni(OH)2의 Ksp = 2^2*[Ni2+][OH-]^2 = 6*10^-16, 용해도 = 5.3*10^-6
Fe(OH)3의 Ksp = 3^3*[Fe3+][OH-]^3 = 2*10^-39, 용해도 = 9.28*10^-5
넷 중 용해도가 가장 큰 화학종은 AgCl
[해설작성자 : 조금일하고많이벌자]
용해도곱 상수가 클수록 용해도가 크다.
[해설작성자 : 만거] |
|
| 18. | 0.1M H2SO4 수용액 10mL에 0.05M NaOH 수용액 10ml를 혼합하였다. 혼합 용액의 pH는? (단, 황산은 100% 이온화되며 혼합 용액의 부피는 20ml 이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 57%
| | <문제 해설>
남은 황산 0.75mmol -> 수소이온 1.5mmol / 50 ml
pH = -log ( 수소이온 농도 ) = 1.125
[해설작성자 : 또또]
H+: 0.1 mol/L x10ml x 2e= 2 mol·ml/L
OH-:0.05mol/L x 10ml = 0.5mol·ml/L
1:1반응, 남은 H+=2-0.5=1.5mol·ml/L
[H+]=(1.5mol·ml/L)/20ml= 0.075mol/L
pH=-log[H+]=-log(0.075)=1.124938….= 약 1.125
[해설작성자 : riririm] |
|
| 19. | 1.20g의 유황(S)을 15.00g의 나프탈렌에 녹였더니 그 용액의 녹는점이 77.88℃이었다. 이 유황의 분자량(g/mol)은? (단, 나프탈렌의 녹는점은 80.00℃이고, 나프탈렌의 녹는점 강하상수(Kf)는 –6.80℃/m 이다.) |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 59%
| | <문제 해설>
몰랄농도의 정의를 이용하여 단위를 맞춰서 정리하면,
(77.88-80.00)℃/(-6.80℃/m) = (1.20g/x)/0.015kg
x = 257g/mol
[해설작성자 : 조금일하고많이벌자] |
|
| 20. | 주기율표에 대한 설명 중 옳지않은 것은? |
| 1. | 주기율표란 원자번호가 증가하는 순서로 원소들을 배열하여 화학적 유사성을 한눈에 볼 수 있도록 만든 표이다. |
| 2. | 주기율표를 이용하면 화학정보를 체계적으로 분류, 해석, 예측할 수 있다. |
| 3. | 원소를 족(group)과 주기(period)에 따라 배열하고 있다. |
| 4. | 전이금속원소는 10개로 나뉘어져 있으며, 원자번호 51~71번을 악티늄족이라 부른다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 90%
| | <문제 해설>
4. 원자번호 57~71번은 란탄족이며, 악티늄족은 원자번호 89~103번이다.
[해설작성자 : 조금일하고많이벌자] |
|
| 21. | EDTA 적정에서 역적정에 대한 설명으로 틀린 것은? |
| 1. | 역적정에서는 일정한 소량의 EDTA를 분석용액에 가한다. |
| 2. | EDTA를 제2의 금속 이온 표준용액으로 적정한다. |
| 3. | 역적정법은 분석물질이 EDTA를 가하기 전에 침전물을 형성하거나, 적정 조건에서 EDTA와 너무 천천히 반응하거나, 혹은 지시약을 막는 경우에 사용한다. |
| 4. | 역적정에서 사용되는 제2의 금속 이온은 분석물질의 금속 이온을 EDTA 착물로부터 치환시켜서는 안 된다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 57%
| | <문제 해설>
시료용액에 표준용액을 과량 가하여 충분히 반응시킨 후, 남은 과잉량을 다른 적당한 표준액으로 적정시키는 것이 역적정이다.
[해설작성자 : yeon] |
|
| 22. | 0.05M Na2SO4 용액의 이온세기는? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
0.05M * (2+1) = 0.15M |
|
| 23. | 침전과정에서 결정성장에 관한 설명으로 틀린 것은? |
| 1. | 침전물의 입자크기를 증가시키기 위하여 침전물이 생성되는 동안에 상대 과포화도를 최소화하여야 한다. |
| 2. | 핵심 생성(nucleation)이 지배적이라면 침전물은 매우 작은 입자로 구성된다. |
| 3. | 입자 성장(particle growth)이 지배적이면 침전물은 큰 입자들로 구성한다. |
| 4. | 핵심 생성(nucleation) 속도는 상대 과포화도가 감소함에 따라 직선적으로 증가한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 68%
| | <문제 해설>
4. 입자성장속도는 상대 과포화도에 따라 직선적으로 증가하며, 핵심생성속도는 입자의 성장속도보다 상대 과포화도에 더 크게 의존한다.
[해설작성자 : 만거]
조금 해설이 부족해 보여서 추가합니다.
4. 입자성장속도는 상대과포화도에 따라 직선적으로 완만하게 증가.
핵 생성 속도는 상대과포화도에 따라 지수함수적으로 증가.
더 크게 의존한다는 말만으로는 직선적으로 증가도 포함됩니다. ( 2배, 3배 )
[해설작성자 : Rivolo] |
|
| 24. | 그림과 같이 다이싸이올알케인의 전도도는 사슬의 길이가 길어질수록 기하급수적으로 감소하는데 그 이유는 무엇인가? |
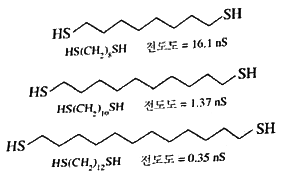
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 84%
|
| 25. | Pb2+는 I-와 반응하여 PbI2 침전을 만들기도 하지만 PbI+,PbI2(aq),PbI3-, PbI42-의 착물을 형성하기도 한다. Pb2+와 I-의 착물 형성상수는 각각 β1 = 1.0×102, β2 = 1.4×103, β3 = 8.3×103, β4 = 3.0×104이고 Ksp(PbI2) = 7.9×10-9일 때, 0.1M의 Pb2+ 수용액에 I-를 1.0×10-4M에서 5M 정도 될 때까지 천천히 첨가할 경우에 대한 설명으로 옳지 않은 것은? |
| 2. | 수용액 중 Pb2+의 농도는 계속 감소한다. |
| 3. | 수용액 중 PbI3-의 농도는 계속 증가한다. |
| 4. | 수용액 중에 녹아 있는 전체 Pb2+ 농도는 일정하다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 56%
| | <문제 해설>
Pb2+ 와 I-가 반응하여 착물을 형성하기 때문에 농도가 일정하지 않다.
[해설작성자 : 어려웡] |
|
| 26. | S4O62- 이온에서 황(S)의 산화수는 얼마인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 83%
| | <문제 해설>
O의 산화수 -2 / O 갯수 6
-2 x 6 = -12
S의 산화수 모름, S의 갯수 4
S산화수 x 4 -12 = -2
S산화수 = 2.5
[해설작성자 : 23.05.20 공기업 필기시험인데 이제공부하고있음] |
|
| 27. | Mg2+이온과 EDTA와의 착물 MgY2-를 포함하는 수용액에 대한 다음 설명 중 틀린 것은? (단, Y4-는 수소이온을 모두 잃어버린 EDTA의 한 형태이다.) |
| 1. | Mg2+와 EDTA의 반응은 킬레이트 효과로 설명할 수 있다. |
| 2. | 용액의 pH를 높일수록 해리된 Mg2+이온의 농도는 감소한다. |
| 3. | 해리된 Mg2+이온의 농도와 Y4-의 농도는 서로 같다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 28. | 다음 식 HOCl ⇌ H+ + OCl-은 K1 = 3.0×10-8, HOCl + OBr- ⇌ HOBr + OCl-은 K2 = 15로부터 반응 HOBr ⇌ H+ + OBr-에 대한 K값은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 64%
| | <문제 해설>
HOCl ⇌ H+ + OCl- ... K1
HOBr + OCl- ⇌ HOCl + OBr- ... K2^-1
이 둘을 합치면
HOBr ⇌ H+ + OBr- ... K1/K2 = 3.0×10^-8/15 = 2.0^10^-9 |
|
| 29. | 난용성 염 포화용액 성분의 My+와 Ax-를 포함하는 용액에서 두 이온의 농도 곱을 용해도곱(solubility product; Ksp)이라고 한다. 이 값은 온도가 일정하면 항상 일정한 값을 갖는다. 이 때 [My+]x와 [Ax-]y의 곱이 Ksp보다 클 때 용액에서 나타나는 현상은? |
| 1. | 농도곱이 Ksp와 같아질 때까지 침전한다. |
| 2. | 농도곱이 Ksp와 같아질 때까지 용해된다. |
| 3. | Ksp와 무관하게 항상 용해되어 침전하지 않는다. |
| 4. | 반응 종료 후 용액의 상태는 포화이므로 침전하지 않는다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 76%
| | <문제 해설>
MA->M +A
Ksp 값보다 [M][A]값이 크면 같아질때 까지 감소하므로 역반응이 진행되어 침전된다.
(첨자 표시하면 너무 복잡해져서 생략함)
[해설작성자 : 합격하고싶어요] |
|
| 31. | HgS는 산성과 알칼리성 H2S 용액 모두에서 침전되고, ZnS는 알칼리성 H2S 용액에서만 침전된다. 이로부터 알 수 있는 HgS와 ZnS의 용해도곱 상수의 크기는? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 65%
| | <문제 해설>
용해도곱 : 포화용액에서 양이온과 음이온의 농도의 곱
: 일정한 온도에서 일정한 값을 가짐
용해도곱이 작을 수록 침전이 잘 됨
- HgS는 산성과 알칼리성 용액에서 모두 침전
- ZnS는 알칼리성에서만 침전
∴HgS의 용해도곱이 더 작다
[해설작성자 : wlrma] |
|
| 32. | pKa = 7.00인 산 HA가 있을 때 pH 6.00에서  의 값은? 의 값은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
HA->H+ + A-
Ka=[A-][H+]/[HA]
[A-]/[HA]=Ka/[H+]=10^-7/10^-6=0.1
(pH=6이므로 [H+]=10^-6)
[해설작성자 : 오풀리네] |
|
| 33. | 완충용액에 적용되는 Henderson-Hasselbalch equation(헨더슨-하셀바흐식)은? |
| 1. | pH = -pKa + log([A-]/[HA]) |
| 2. | pH = pKa + log([A-]/[HA]) |
| 3. | pH = pKa - log([A-]/[HA]) |
| 4. | pH = -pKa - log([A-]/[HA]) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 83%
| | <문제 해설>
HA -> H+ + A-
Ka=[H+][A-]/[HA]
[H+]=Ka[HA]/[A-]
pH=-log[H+]=-log(Ka[HA]/[A-])=pKa+log([A-]/[HA])
[해설작성자 : 풀어따] |
|
| 34. | 이온선택성 전극(ion selective electrode)에 대한 설명으로 틀린 것은? |
| 1. | 복합전극(compound electrode)에서는 은-염화은 전극을 기준전극으로 사용할 수 있다. |
| 2. | 복합전극 용액 중에 함유된 CO2, NH3 등의 기체의 농도를 측정하는데 사용될 수 있다. |
| 3. | 고체상(solid state) 이온선택성 전극에서 전극내부의 충전용액은 분석하고자 하는 이온이 함유되어 있다. |
| 4. | 고체상 이온선택성 전극의 이온 감지부분(membrane crystal)은 분석하고자 하는 이온만을 함유한 순수한 고체결정을 사용해야 한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 58%
| | <문제 해설>
4. 고체상 이온선택성 전극의 이온 감지부분(membrane crystal)은 분석하고자 하는 이온만을 함유한 순수한 고체결정은 아니다.
[해설작성자 : 만거]
3. 특정이온의 농도에 따라 전위가 변하는 전극을 이온선택성 전극 이라고 한다. LaF3는 F-이온 농도측정에, AgS는 Ag+ 또는 S2-농도측정에 사용된다.
4. 고체상 이온선택성 전극의 이온감지 부분은 분석하고자 하는 이온만을 함유한 순수한 고체 결정은 아니다.
[해설작성자 : 합격하고싶어요]
위에 해설 중 3번 4번이 결국 같은 내용입니다만.. 이해하기 힘들게 쓰셔서 다듬었습니다.
4. 불용성 무기염 결정으로 분석하고자 하는 이온을 함유하는 결정이다. ( 분석 이온+그 외 물질)
예: LaF3 -> F- 선택성 전극
ISE의 특징이 특정 이온과 선택적으로 감응한다 입니다. 그러면 그 이온과 반응하는 물질이면서 반응해도 무관한 물질이겠죠?
( 1번 쓰고 버릴 건 아니므로 반응해도 무관해야 합니다 )
그리고 3번 내용을 추가하면 분석 원리는 막을 기준으로 양쪽(내부, 외부)의 전위차 측정하여 농도 추정합니다.
[해설작성자 : Rivolo] |
|
| 35. | 농도가 19.5%로 표시되어 있는 술의 에탄올 농도는? (단, 농도는 부피비로 나타내었다고 가정하고, 물의 밀도는 1.00g/mL 이고, 에탄올의 밀도는 0.789g/mL 이며, 에탄올의 분자량은 46.0g/mol 라고 가정한다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 65%
| | <문제 해설>
195mL 에탄올 / 1L 술 * 0.789g/mL 에탄올 / 46g/mol 에탄올
= 3.34mol 에탄올 / 1L 술
= 3.34M
[해설작성자 : 흡광도개시부럴것] |
|
| 36. | 염(salt) 용액에서 활동도(activity)의 설명으로 옳은 것은? |
| 1. | 이온의 활동도는 활동도계수의 제곱에 반비례한다. |
| 3. | 이온의 활동도는 활동도계수에 반비례한다. |
| 4. | 이온의 활동도는 활동도계수의 제곱에 비례한다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
이온의 활동도 = 활동도계수 x 농도
[해설작성자 : 신쫄이 레콜맛] |
|
| 37. | 이산화염소의 산화반응에 대한 화학 반응식에서 ( ) 안에 적합한 화학반응 계수를 차례대로 옳게 나타낸 것은? |
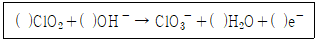
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 82%
|
| 38. | 2003년 발생하여 우리나라에 막대한 피해를 입힌 태풍 매미의 중심기압은 910hPa이었다. 이를 토르(torr) 단위로 환산하면? (단, 1 atm = 101325 Pa, 1torr = 133.322 Pa 이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 75%
| | <문제 해설>
1hPa = 100Pa (h: 헥토, 100배)
910hPa * 1torr/1.33322Pa = 683torr
[해설작성자 : 조금일하고많이벌자] |
|
| 39. | 20℃에서 빈 플라스크의 질량은 10.2634g이고, 증류수로 플라스크를 완전히 채운 후의 질량은 20.2144g 이었다. 20℃에서 물 1g의 부피가 1.0029 mL일 때, 이 플라스크의 부피를 나타내는 식은? |
| 1. | (20.2144 – 10.2634) × 1.0029 |
| 2. | (20.2144 – 10.2634) ÷ 1.0029 |
| 3. | 1.0029 + (20.2144 – 10.2634) |
| 4. | 1.0029 ÷ (20.2144 – 10.2634) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 79%
| | <문제 해설>
(20.2144 - 10.2634)g × 1.0029mL/g
[해설작성자 : 조금일하고많이벌자] |
|
| 41. | 복사선의 파장보다 대단히 작은 분자나 분자의 집합체에 의하여 탄성 산란되는 현상을 무엇이라 하는가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 42. | 단색 X-선 빛살의 광자가 K-껍질 및 L-껍질의 내부전자를 방출시켜 방출된 전자의 운동에너지를 측정하여 시료원자의 산화 상태와 결합 상태에 대한 정보를 동시에 얻을 수 있는 전자 분광법은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 43. | CH3CH2CH2OCH3 분자는 핵자기공명(NMR) 스펙트럼에서 몇 가지의 다른 화학적 환경을 가지는 수소가 존재하는가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 74%
|
| 44. | 일반적으로 신호-대-잡음비가 얼마 이하일 때 신호를 사람의 눈으로 관찰이 불가능해지는가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 62%
| | <문제 해설>
일반적으로 S/N이 약 2~3보다 작으면 신호를 사람의 눈으로 관찰하기 불가능해진다.
[해설작성자 : 화분기위산기] |
|
| 45. | 복사선을 흡수하면 에너지 준위 사이에서 전자 전이가 일어나게 되는데 다음 전이 중 파장이 가장 짧은 복사선을 흡수하는 전자전이는? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 58%
|
| 46. | UV/VIS을 이용하여 미지의 샘플을 10mm 용기(cell)를 이용하여 흡광도를 측정했을 때, 흡광도가 0.1이면 같은 샘플을 50mm 용기(cell)로 측정했다면 흡광도 값은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 79%
| | <문제 해설>
A = abc
흡광도(A)값은 셀의 길이에 비례함
셀의 길이가 5배 증가했기때문에 흡광도 값 역시 5배 증가
∴0.5
[해설작성자 : wlrma] |
|
| 47. | NMR 기기를 이루는 중요한 4가지 구성에 해당하지 않는 것은? |
| 2. | 대단히 작은 범위에 자기장을 연속적으로 변화할 수 있는 장치 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 64%
| | <문제 해설>
NMR 기기를 이루는 구성요소
- 자석
- 라디오파 발신기
- 라디오파 검출기
- 시료관 및 자기코일
[해설작성자 : wlrma] |
|
| 48. | 분자의 들뜬 상태(excited state)에 대한 설명으로 틀린 것은? |
| 3. | 분자가 마이크로파의 복사선을 흡수한 상태 |
| 4. | 분자가 광자를 방출하여 주변의 에너지 준위가 높아진 상태 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 59%
| | <문제 해설>
4. 분자가 광자를 방출하면서 낮은 에너지 준위 상태에 있는 것을 바닥 상태라 한다.
[해설작성자 : 만거] |
|
| 49. | 나트륨(Na) 기체의 전형적인 원자 흡수스펙트럼을 옳게 나타낸 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 79%
|
| 50. | 유도결합플라스마(ICP) 원자방출 분광법이 원자흡수분광법과 비교하여 가지는 장점에 대한 설명으로 틀린 것은? |
| 1. | 동시에 여러 가지 원소들을 분석할 수 있다. |
| 2. | 낮은 온도에서 분석을 수행하므로 원소간의 방해가 적다. |
| 3. | 일반적으로 더 낮은 농도까지 측정할 수 있다. |
| 4. | 잘 분해되지 않는 산화물들의 분석이 가능하다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 70%
| | <문제 해설>
2. 높은 온도에서 분석을 수행하므로 원소 간의 방해가 작다.
[해설작성자 : 만거] |
|
| 51. | 이산화탄소 분자는 모두 몇 개의 기준 진동방식을 가지는가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 71%
| | <문제 해설>
선형분자: 3N-5
비선형분자: 3N-6
CO2: 선형분자, N = 3
3N-5 = 3*3-5 = 4 |
|
| 52. | 원자화 온도가 가장 높은 원자분광법의 원자화 장치는? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 67%
|
| 53. | 유도결합플라스마(ICP)를 이용하여 금속을 분석할 경우 이온화 효과에 의한 방해가 발생되지 않는 주된 이유는? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 54. | 푸리에(Fourier) 변환을 이용하는 분광법에 대한 설명으로 틀린 것은? |
| 1. | 기기들이 복사선의 세기를 감소시키는 광학부분장치와 슬릿을 거의 가지고 있지 않기 때문에 검출기에 도달하는 복사선의 세기는 분산기기에서 오는 것보다 더 크게 되므로 신호-대-잡음비가 더 커진다. |
| 2. | 높은 분해능과 파장 재현성으로 인해 매우 많은 좁은 선들의 겹침으로 해서 개개의 스펙트럼의 특성을 결정하기 어려운 복잡한 스펙트럼을 분석할 수 있게 한다. |
| 3. | 광원에서 나오는 모든 성분 파장들이 검출기에 동시에 도달하기 때문에 전체 스펙트럼을 짧은 시간 내에 얻을 수 있다. |
| 4. | 푸리에 변환에 사용되는 간섭계는 미광(stray light)의 영항을 받으므로 시간에 따른 미광의 영향을 최소화하기 위하여 빠른 감응검출기를 사용한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 59%
| | <문제 해설>
4. 푸리에 변환에 사용되는 간섭계는 미광의 영향을 안 받는다.
[해설작성자 : 만거] |
|
| 55. | X-선 분광법에 대한 설명으로 틀린 것은? |
| 1. | 방사성 광원은 X-선 분광법의 광원으로 사용될 수 있다. |
| 2. | X-선 광원은 연속 스펙트럼과 선스펙트럼을 발생시킨다. |
| 3. | X-선의 선스펙트럼은 내부 껍질 원자 궤도함수와 관련된 전자 전이로부터 얻어진다. |
| 4. | X-선의 선스텍트럼은 최외각 원자 궤도함수와 관련된 전자 전이로부터 얻어진다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 65%
| | <문제 해설>
X선 광자의 흡수는 원자로부터 최내각 전자 하나를 제거하여 들뜬 이온을 생성한다.
[해설작성자 : 만거] |
|
| 56. | Monochromator 의 slit width를 증가시켰을 때 발생하는 현상으로 가장 옳은 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 67%
| | <문제 해설>
단색화 장치는 슬릿의 너비와 해상도가 반비례한다.
[해설작성자 : 만거] |
|
| 57. | X-선 분석에서 Bragg식은 다음 중 어떤 현상에 대해 나타낸 식인가? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 82%
|
| 58. | 원자분광법에서 액체 시료를 도입하는 장치에 대한 설명으로 틀린 것은? |
| 1. | 기압식 분무기 : 용액 시료를 준비하여 분무기로 원자화 장치 안으로 불어 넣는다. |
| 2. | 초음파 분무기 : 20 kHz ~ 수 MHz로 진동하는 소자를 이용한다. 이 소자의 표면에 액체 시료를 주입하면 균일한 에어로졸을 형성시킨 후 이를 원자화 장치안으로 이동시킨다. |
| 3. | 전열 증기화 장치 : 전기방전이 시료표면에서 상호작용하여 증기화된 입자시료 집합체를 만든 다음 비활성기체의 흐름에 의해 원자화장치로 운반된다. |
| 4. | 수소화물 생성법 : 휘발성 수소화물을 생성시켜 이용하는 방법으로 NaBH4 수용액을 이용한다. 휘발성이 높아진 시료는 바로 도입이 가능하다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 47%
| | <문제 해설>
3. 비활성 기체가 아닌 고체시료
[해설작성자 : 만거]
전열증기화법에서 시료를 가열하여 전압을 조절하여 온도를 높여 증기화한다. 이를 아르곤과 같은 비활성기체의 흐름을 통해 원자화 장치로 전달 한다. 때문에 "전기방전"하여 증기화 한다는 부분이 틀린부분이다.
[해설작성자 : 합격하고싶어요] |
|
| 59. | 아래 표에서 ( ) 안에 알맞은 것은? |

정답 : [3]☜ 블럭 설정하면 보임
정답률 : 75%
|
| 60. | N개의 원자로 이루어진 분자가 적외선(IR)흡수분광법에서 나타내는 진동방식(vibratinal mode)은 선형분자의 경우 3N-5인데, 비선형분자의 경우 3N-6이다. 이렇게 차이가 나는 주된 이유는? |
| 1. | 선형분자의 경우 자신의 축을 중심으로 회전하는 운동에서 위치 변화가 없기 때문에 |
| 2. | 선형분자의 경우 양끝에서 당기는 운동에 관해서 쌍극자의 변화가 없기 때문에 |
| 3. | 선형분자의 경우 원자들이 동일한 방향으로 병진 운동하기 때문에 |
| 4. | 선형분자의 경우 에너지 준위 사이의 차이가 작기 때문에 |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 58%
|
| 61. | 전위차법에서 이온선택성 막의 성질로 인해 어떤 양이온이나 음이온에 대한 막전극들의 감도와 선택성을 나타낸다. 이 성질에 해당하지 않는 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 53%
|
| 62. | 불꽃이온화검출기(FID)에 대한 설명으로 틀린 것은? |
| 3. | 불꽃을 통해 전기를 운반할 수 있는 전자와 이온을 만든다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 70%
| | <문제 해설>
2. 사용가스는 수소와 공기이다.
[해설작성자 : 만거] |
|
| 63. | 상온에서 다음 전극계의 전극전위는 약 얼마인가? (단, 각 이온의 농도는 Cr3+ = 2.00×10-4M, Cr2+ = 1.00×10-3M, Pb2+ = 6.50×10-2M 이다.) |

정답 : [4]☜ 블럭 설정하면 보임
정답률 : 41%
| | <문제 해설>
2Cr3+ + 2e- -> 2Cr2+, E' = -0.408V, Pb식은 그대로 쓴다. E' = E+' - E-' = 0.282V이다. 띠리서 E = 0.282 - (0.05916 / 2) x log((2.00 x 10^-4)^2 / 6.50 x 10^-2 x (1.00 x 10^-3)^2) = 0.288V이다.
[해설작성자 : 신쫄이 레콜맛] |
|
| 64. | 크로마토그래피에서 봉우리 넓힘에 기여하는 요인에 대한 설명으로 틀린 것은? |
| 1. | 충전입자의 크기는 다중 통로 넓힘에 영향을 준다. |
| 2. | 이동상에서의 확산계수가 증가할수록 봉우리 넓힘이 증가한다. |
| 4. | 충전입자의 크기는 질량이동계수에 영향을 미친다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 75%
| | <문제 해설>
3. 세로확산은 이동상의 속도에 반비례한다.
[해설작성자 : 만거] |
|
| 65. | 기체 크로마토그래피 분리법에 사용되는 운반기체로 부적당한 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 73%
|
| 66. | 액체 크로마토그래피에서 보기에서 설명하는 검출기는? |

정답 : [1]☜ 블럭 설정하면 보임
정답률 : 50%
|
| 67. | 미셀 동전기 모세관 크로마토그래피에 대한 설명으로 틀린 것은? |
| 3. | 겔 전기 이동으로 분리할 수 없는 작은 분자를 분리하는데 유용하다. |
| 4. | 고압 펌프를 사용하여 전하를 띠지 않는 화학종을 분리할 수 있다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 47%
| | <문제 해설>
계면활성제를 임계미셸농도이상으로 가하 표면에 "음전하를 띤 " 미셸이 형성되게 하여 분리하는 방법임
[해설작성자 : 뿌뿌] |
|
| 68. | 0.010M Cd2+ 용액에 담겨진 카드뮴 전극의 반쪽전지의 전위를 계산하면? (단, 온도는 25℃이고 Cd2+/Cd 의 표준환원 전위는 –0.403V 이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 69. | 분광질량분광법의 이온화 방법 중 사용하기 편리하고 이온전류를 발생시키므로 매우 예민한 방법이지만 열적으로 불안정하고 분자량이 큰 바이오 물질들의 이온화원에는 부적당한 방법은? |
| 2. | Electro Spray Ionization(ESI) |
| 3. | Fast Atom Bombardment(FAB) |
| 4. | Matrix-Assisted Laser Desorption Ioization(MALDI) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 62%
|
| 70. | 자기장부채꼴 질량분석기의 구성이 아닌 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 57%
|
| 71. | 작용기를 가지는 화합물은 하나 이상의 전압전류를 생성시킬 수 있다. 이런 활성 작용기에 해당하지 않는 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 53%
| | <문제 해설>
한 개 또는 그 이상의 전압전류파를 생성시키는 작용기
- 카보닐기 - 대부분의 유기 할로젠기
- 일부 카복실산 - 탄소-탄소 이중결합
- 대부분의 과산화물과 에폭시 화합물 - 하이드로퀴논과 메르캅탄
- 나이트로기, 나이트로소기, 산화아민 및 아조기
[해설작성자 : 만거] |
|
| 72. | GC의 열린관 컬럼 중 유연성이 우수하고 화학적으로 비활성이며, 분리 효율이 아주 우수한 컬럼은? |
| 2. | 용융실리카 벽도포 열린관 컬럼(FSWT) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 72%
|
| 73. | HPLC에서 분배 크로마토그래피에 응용에 대한 설명으로 옳은 것은? |
| 1. | 역상 충진(reversed-phase packings) 칼럼을 사용하고 극성이 큰 이동상으로 용리하면 극성이 작은 용질이 먼저 용리되어 나온다. |
| 2. | 정상 결합상 충전물(normal-phase bonded packings)에서 실옥산(siloxane) 구조에 있는 R은 비극성 작용기가 일반적이다. |
| 3. | 이온쌍 크로마토그래피에서는 정지상에 큰 유기 상대이온을 포함하는 유기 염을 결합시켜 분리 용질과의 이온쌍 형성에 기초하여 분리한다. |
| 4. | 거울상을 가지는 키랄 화합물(ciral compounds)의 분리를 위해 키랄 크로마토그래피가 응용되는데 키랄 이동상 첨가제나 키랄 정지상을 사용하여 분리한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 56%
|
| 74. | 전기화학전지에 대한 설명으로 틀린 것은? |
| 1. | 산화전극과 환원전극이 외부에서 금속전도체로 연결된다. |
| 2. | 두 개의 전해질 용액은 이온을 한쪽에서 다른 쪽으로 이동할 수 있게 간접적으로 접촉된다. |
| 3. | 두 개의 전극 각각에서 전자이동 반응이 일어난다. |
| 4. | 용액 사이의 간접적 접촉을 통하여 산화반응에 의해 주어지는 전자가 환원반응이 일어나는 용액으로 이동한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 48%
| | <문제 해설>
전자는 도선을 통해 산화전극에서 환원전극으로 이동한다.
[해설작성자 : 신쫄이 레콜맛] |
|
| 75. | 질량분석법은 여러 가지 성분의 시료를 기체상태로 이온화한 다음 자기장 혹은 전기장을 통해 각 이온을 질량/전하의 비에 따라 분리하여 질량스펙트럼을 얻는 방법이다. 질량분석기의 기기장치 중 진공으로 유지되어야 하는 부분이 아닌 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 73%
| | <문제 해설>
4. 신호처리기는 출력장치이므로 진공으로 유지될 필요가 없다.
[해설작성자 : 만거] |
|
| 76. | 중합체를 분석하는 시차주사 열량법(DSC)에 대한 설명으로 틀린 것은? |
| 1. | 시료와 기준물질 간의 온도 차이를 측정한다. |
| 2. | 결정화 온도(Tc)는 발열 봉우리로 나타난다. |
| 3. | 유리전이 온도(Tg) 전후에은 열흐름(heat flow)의 변화가 생긴다. |
| 4. | 결정화 온도(Tc)는 유리전이 온도(Tg)와 녹는점 온도(Tm)사이에 위치한다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 63%
| | <문제 해설>
1. 에너지 차이
[해설작성자 : 만거] |
|
| 77. | 질량 분석법에서는 질량-대-전하의 비에 의하여 원자 또는 분자 이온을 분리하는데 고진공 속에서 가속된 이온들을 직류 전압과 RF 전압을 일정속도로 함께 증가시켜주면서 통로를 통과하도록 하여 분리하며 특히 주사시간이 짧은 장점이 있는 질량 분석기는? |
| 1. | 이중 초점 분석기(double focusing spectrometer) |
| 2. | 사중극자 질량분석기(quadrupole mass spectrometer) |
| 3. | 비행시간 분석기(time-of-flight spectrometer) |
| 4. | 이온-포착분석기(ion-trap spectrometer) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 65%
|
| 78. | 액체막(liquid membrane) 칼슘 이온선택성 전극을 이용하여 용액의 Ca2+ 농도를 결정하고자 한다. 미지시료 25.0mL 에 칼슘이온 선택성 전극을 담가 전위를 측정하였더니 전위가 497.0mV 이었다. 미지시료에0.0500M 농도의 CaCl2 용액 2.00mL를 첨가하여 전위를 측정하였더니 전위가 512.0mV 이었다. 이온선택성전극이 Nernst 식을 따른다면 미지용액에서의 칼슘이온의 농도는? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 30%
|
| 79. | 열무게법(TG)에서 전기로르 질소와 아르곤으로 환경기류를 만드는 주된 이유는? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 82%
|
| 80. | 액체 크로마토그래피에서 극성이 서로 다른 혼합물을 가장 효과적으로 분리하는 방법으로서 기체크로마토그래피에서 온도프로그래밍을 이용하여 얻은 효과와 유사한 효과가 있는 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 81%
|
화학분석기사(구) 필기 기출문제(해설) 및 CBT 2019년09월21일을 이용해 주셔서 감사합니다.
, 필기, 기출문제, 전자문제집, CBT, 온라인, 모의테스트, 모의고사

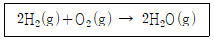
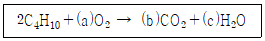


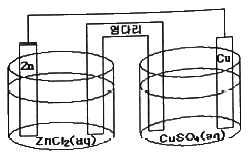
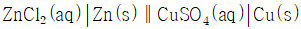
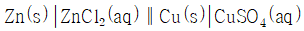
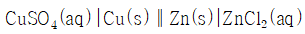
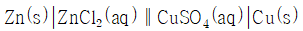
 의 값은?
의 값은?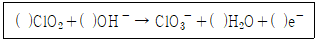
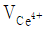 = 50.0mL일 때 당량점에 도달한다면 36.0mL를 가했을 때의 전지 전압은? (단,
= 50.0mL일 때 당량점에 도달한다면 36.0mL를 가했을 때의 전지 전압은? (단, 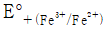 = 0.767 V,
= 0.767 V, 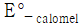 = 0.241 V)
= 0.241 V)