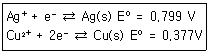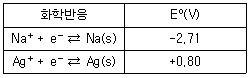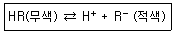위 이미지를 클릭하시면 인터넷으로 바로 문제를 풀어 보실수 있습니다.
(해설, 모의고사, 오답노트, 워드, 컴활, 정보처리 상설검정 프로그램 기능 포함)
전자문제집 CBT란?
종이 문제집이 아닌 인터넷으로 문제를 풀고 자동으로 채점하며 모의고사, 오답 노트, 해설까지 제공하는
무료 기출문제 학습 프로그램으로 실제 상설검정에서 사용하는 OMR 형식의 CBT를 제공합니다.
최신 화학분석기사(구) 필기 기출문제(해설) : [다운로드]
화학분석기사(구) 필기 기출문제(해설) 및 전자문제집 CBT 2014년09월20일| 1. | 산화환원반응에서 전자를 받아들이는 화학종을 무엇이라고 하는가? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 91%
| | <문제 해설>
산화 : 산소 얻음, 산화수 증가, 전자 잃음, 수소 잃음
환원 : 산소 잃음, 산화수 감소, 전자 얻음, 수소 얻음
[해설작성자 : 만거] |
|
| 2. | 주기율표에서의 일반적인 경량으로 옳은 것은? |
| 1. | 원자 반지름은 같은 족에서는 위로 올라갈수록 증가한다. |
| 2. | 원자 반지름은 같은 주기에서는 오른쪽으로 갈수록 감소한다. |
| 3. | 같은 주기에서는 오른쪽으로 갈수록 금속성은 증가한다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 92%
|
| 3. | 소금이나 설탕 등과 같은 고체화합물을 용액 속에서 용해할 때, 그 용해 속도를 증가시킬 수 있는 요인은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 93%
|
| 4. | C4H8의 모든 이성질체의 개수는 몇 개인가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 5. | 어떤 반응의 평형상수를 알아도 예측할 수 없는 것은? |
| 3. | 주어진 초기농도로부터 도달할 수 있는 평형의 위치 |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 90%
|
| 6. | 다음 아보가드로 수와 관련된 설명 중 틀린 것은? |
| 3. | 표준 상태의 수소 기체 22.4L 중의 수소 분자 수 |
| 4. | 표준 상태의 암모니아 기체 5.6L 중의 수소 원자 수 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 77%
| | <문제 해설>
암모니아 분자식은 NH3 이다. 7.5L중의 수소 원자수 여야 한다.
[해설작성자 : 만거] |
|
| 7. | 물 90.0g에 포도당(C6H12O6) 4.80g이 녹아 있는 용액에서 포도당의 몰랄농도를 구하면? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 80%
|
| 8. | C, H, O로 이루어진 화합물이 있다. 이 화합물 1.543g을 완전연소시켰더니 CO2 2.952ㅎ, H2O 1.812g이 생겼다. 이 화합물의 실험식에 해당하는 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 60%
| | <문제 해설>
C : 2.952g x (12/44)g = 0.8015g
H : 1.812g x (2/18)g = 0.2013g
O : 1.543g - (0.8051 + 0.2013)g = 0.5366g
0.8051/12 : 0.2013 : 0.5366/16 = 2 : 6 : 1
[해설작성자 : 만거] |
|
| 9. | 중성의 염소(Cl) 원자는 17번지의 원자 번호를 가지며 37의 질량수를 가진다. 중성 염소 원자의 양성자, 중성자, 전자의 개수를 옳게 나열한 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 91%
|
| 10. | 물질의 구성에 관한 설명 중 틀린 것은? |
| 1. | 몰(mole) 질량의 단위는 g/mol이다. |
| 2. | 아보가드로 수는 수소 12.0g 속의 수소 원자의 수에 해당한다. |
| 3. | 몰(mole)은 아보가드로 수만큼의 입자들로 구성된 물질의 양을 의미한다. |
| 4. | 분자식은 분자를 구성하는 원자의 종류와 수를 원소 기호를 사용하여 나타낸 화학식이다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 91%
|
| 11. | 다음과 같은 가역반응이 일어난다고 가정할 때 평형을 오른쪽으로 이동시킬 수 있는 변화는? |

정답 : [4]☜ 블럭 설정하면 보임
정답률 : 87%
|
| 12. | 다음 중 가장 큰 2차 이온화 에너지를 가지는 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 66%
| | <문제 해설>
소듐은 전자 하나 잃으면 안정한 상태가 되기 때문에 2차 이온화 에너지가 매우 커진다.
[해설작성자 : 만거] |
|
| 13. | [Fe2+]=0.02M이고 [Cd2+]=0.20M일 때 298K에서 다음 산화-환원 반응의 전지전위(V)는 약 얼마인가? |
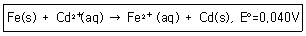
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 67%
| | <문제 해설>
네른스트식 이용
E = 0.04V - (0.05916/2)log(0.02/0.2) = 0.069
[해설작성자 : 만거] |
|
| 14. | 수용액에서 약간 용해하는 이온화합물 Ag2CO3(s)의 용해도곱 평형상수(Ksp)식이 맞는 것은? |
| 3. | Ksp=2[Ag+]2[CO32-]/[Ag2CO3] |
| 4. | Ksp=[Ag2+][CO3-]/[Ag2CO3] |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 80%
|
| 15. | 산과 염기의 정의에 대한 설명 중 틀린 것은? |
| 1. | 아레니우스 염기는 물에서 해리하여 수산화이온을 내놓는 물질이다. |
| 2. | 브뢴스태드-로우리 산은 수소이온 주개로 정의한다. |
| 3. | 브뢴스태드-로우리 염기는 양성자 주개로 정의한다. |
| 4. | 아레니우스 산은 물에서 이온화되어 수소이온을 생성하는 물질이다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 81%
| | <문제 해설>
양성자 받개
[해설작성자 : 만거] |
|
| 16. | O2-, F, F-를 지름이 작은 것부터 큰 순서로 옳게 나열한 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 84%
| | <문제 해설>
음이온은 전자를 많이 받을수록 크기가 커진다.
[해설작성자 : 만거] |
|
| 17. | sp3 혼성궤도함수가 참여한 결합을 가진 물질은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
sp3 단일결합으로 이루어진 혼성궤도함수
[해설작성자 : 만거] |
|
| 18. | 0.195M H2SO4 용액 15.5L를 만들기 위해 18.0M H2SO4용액 얼마를 물로 희석시켜야 하는가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 86%
| | <문제 해설>
0.195 x 15.5 / 18 = 0.168L
[해설작성자 : 만거] |
|
| 19. | 수소이온의 농도가 1.0×10-7M 용액의 pH는? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 89%
| | <문제 해설>
pH = -log[H+] = -log[1.0x10^-7] = 7
[해설작성자 : 만거] |
|
| 20. | 몰랄농도가 3.24m인 K2SO4 수용액 내 K2SO4의 몰분율은? (단, 원자량은 K가. 39.10, 0는 16.00, H는 1.008, S는 32.06이다.) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 56%
| | <문제 해설>
K2SO4 몰수 : 3.24m
H2O 몰수 : 1kg H2O x (1mol H2O / 18.016g H2O) x (1000g / 1kg) = 55.506mol
몰분율 = K2SO4 몰수 / 총 몰수 = 3.24mol / (55.506 + 3.24)mol = 0.0551mol
[해설작성자 : 만거] |
|
| 21. | 어떤 유기산 10.0g을 녹여 100mL 용액을 만들면, 이 용액에서의 유기산의 해리도는 2.50%이다. 유기산은 일양성자산이며, 유기산의 Ka가 5.00×10-4 이었다면, 유기산의 화학식량은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 50%
| | <문제 해설>
HA -> H+ + A-
초기 x 0 0
반응 -0.025x +0.025x +0.025x
최종 0.0975x 0.025x 0.025x
Ka = [H+][A-] / [HA] = (0.025x)^2 / 0.975x = 5.00 x 10^-4
몰농도 x = 0.78mol/L
몰수 = 0.78mol/L x 0.1L = 0.078mol
유기산의 화학식량 = 10.0g / 0.078mol = 128g/mol
[해설작성자 : 만거]
HA의 경우, 0.025x 만큼 반응 시 최종 0.975x
[해설작성자 : YJ] |
|
| 22. | 과망간산칼륨 5.00g을 물에 녹이고 500mL로 묽혀 과망간산칼륨 용액을 준비하였다. Fe2O3를 24.5% 포함하는 광석 0.500g 속에 든 철은 몇 mL의 KMnO4용액과 반응하는가? (단, KMnO4의 분자량은 158.04g/mol, Fe2O3의 분자량은 159.69g/mol이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 42%
| | <문제 해설>
알짜이온 반응식
5Fe^2+ + MnO^4- + 8H+ <=> 5Fe^3+ + Mn^2+ + 4H2O
MnO4- 의 농도 : 5g/158.04g x 2 = 0.0633M
Fe의 농도 : 0.5 x 0.245 / 158.04 x 2 = 1.53 x 10^-3mol
철 : 과망가니즈산 = 5 : 1
( 1.53 x 10^-3 ) / (5 x 0.0633) = 4.86 x 10^-3
부피 4.86mL
[해설작성자 : 만거] |
|
| 23. | 0.10M 황산 용액 1L를 제조하는데 94%(wt/wt), 밀도 1.831g/mL인 진한 황산 몇 mL를 물과 섞어 희석시켜야 하는가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 47%
| | <문제 해설>
*ml x 0.94 x 1.831g/mL = 98g/mol x 0.1mol
*= 5.7mL
[해설작성자 : 만거] |
|
| 24. | 40.00mL의 0.1000M I-를 0.2000M Pb2+로 적정하고자 한다. Pb2+를 5.00mL 첨가하였을 때, 이 용액 속에서 I-의 농도는 몇 M인가? (단, PbI2(s)⇄Pb2+(aq)+2I-(aq), Ksp=7.9×10-9이다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 53%
| | <문제 해설>
I- 몰수 = 0.04 x 0.1 = 4.00 x 10^-3 mol
Pb^2+ 몰수 = 0.2 x 0.005 = 1.00 x 10^-3 mol
PbI2 -> 2I- + Pb^2+
초기농도 4.00 x 10^-3 1.00 x 10^-3
반응농도 1.00 x 10^-3 -2.00 x 10^-3 -1.00 x 10^-3
최종농도 2.00 x 10^-3
I- 농도 = (2.00 x 10^-3)/(0.04L+0.005L) = 0.0444M
[해설작성자 : 만거] |
|
| 25. | 물(H2O)에 관한 일반적인 설명으로 맞는 것은? |
| 2. | 물의 pH가 낮으면, [H+]가. [OH-]보다 적게 존재한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 89%
| | <문제 해설>
1. 산성
2. 많이 존재
4. 가장 무겁다.(밀도 커서)
[해설작성자 : 만거] |
|
| 26. | pH 10으로 완충된 0.1M Ca2+ 용액 20mL를 0.1M EDTA로 적정하고자 한다. 당량점(VEDTA=20mL)에서의 Ca2+ 몰농도(mol/L)는 얼마인가? (단, CaY2-의 K1=5.0×1010이고 Y4-로 존재하는 EDTA분율 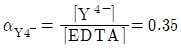 이다.) 이다.) |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 38%
| | <문제 해설>
Ca^2+ + EDTA <=> CaY^2-
[CaY^2-] = 초기농도 x (CaY^2- 부피 / 나중부피) = 0.1M x (20mL/40mL) = 0.05M
Ca^2+ + EDTA <=> CaY^2-
처음농도 0 0 0.05
최종농도 * * 0.05-*
=> [CaY^2-] / [Ca^2+][EDTA] = (0.05-*)/*^2 = 1.75 x 10^10
Kf' = ay2- x Kf = 0.35 x 5.0 x 10^10 = 1.75 x 10^10
0.05-* 는 *작은 값이니 0.05/*^2 = 1.75 x 10^10
* = 1.7 x 10^-6
[해설작성자 : 만거] |
|
| 27. | 전하를 띠지 않는 중성분자들은 이온세기가 0.1M 보다 작을 경우 활동도 계수(actovoty coefficient)를 얼마라고 할 수 있는가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 87%
| | <문제 해설>
비극성 분자, 중성분자의 활동도 계수는 1
[해설작성자 : 만거] |
|
| 28. | 고체에 포함된 Cl-의 양을 측정하기 위하여 고체 시료 5g을 용해시킨 후 과량의 질산은으로 처리하여 AgCl 침전물을 얻었다. 침전물 AgCl을 세척, 건조 과정을 거쳐 무게를 측정하니 0.261g이었다. 고체 시료 내에 포함된 Cl-의 무게 백분율은 얼마인가? (단, AgCl의 분자량은 143.32g/mol이고 Cl의 원자량은 35.453g/mol이다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 55%
| | <문제 해설>
0.261g AgCl x (35.453g/mol / 143.32g.mol) x (1/5g) x 100% = 1.29%
[해설작성자 : 만거] |
|
| 29. | Cu(s)+2Ag+⇄Cu2++2Ag(s) 반응의 평형상수값은 약 얼마인가? (단, 이들 반응을 구성하는 한쪽반응과 표준전극전위는 다음과 같다.) |
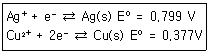
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 46%
| | <문제 해설>
아래와 같은 오류 신고가 있었습니다.
여러분들의 많은 의견 부탁 드립니다.
추후 여러분들의 의견을 반영하여 정답을 수정하도록 하겠습니다.
참고로 정답 변경은 오류 신고 5회 이상일 경우 수정합니다.
[오류 신고 내용]
두번째 조건이 0.377이 아니라 0.337입니당
그래야 값이 나와요
[해설작성자 : comcbt.com 이용자]
[관리자 입니다.
문제지 사진원본 확인해 봤는데
0.377이 맞습니다.
다른 문제집 확인 가능한분 계시면 확인 부탁 드립니다.
신고시 출판사명까지 기제 부탁 드립니다.]
[추가 오류 신고]
오류신고
winQ 2022도 0.377로 나와있지만 문제 오류입니다. 0.337로 되어야 답이 나와요.
[해설작성자 : comcbt.com 이용자]
[추가 오류 신고]
Cu(s)쪽 E = 0.377이 아닌, 0.337로 해야 답이 나옴
[추가 오류 신고]
표준전극전위표(standard reduction potential table) 확인해봤는데 Cu 표준전극전위=0.337V(소수점 두 자리까지 표기 시 0.34V)가 맞습니다.
[해설작성자 : ㅇㅇ]
[관리자 입니다.
문제지 사진원본 확인해 봤는데
원본은 이상이 없습니다만...
추가로 다른 문제집 확인 가능한분 계시면 확인 부탁 드립니다.
한곳만 더 확인하고 수정할수 있도록 하겠습니다.
신고시 출판사명까지 기제 부탁 드립니다.]
[오류신고 반론]
예문기 2024년 정나나 화분기 필기 문제집에는 0.337V로 계산되어있고 답 2번으로 표시되어있습니다~
[해설작성자 : 핑키]
[추가 오류 신고]
0.377 로 계산하면 5.7 x 10^12 가 나옵니다. 0.337 로 계산해야 4.1 x 10^15 가 됩니다.
[해설작성자 : 박건욱]
[관리자 입니다.
다른 문제집 확인 가능한분 계시면 확인 부탁 드립니다.
신고시 출판사명까지 기제 부탁 드립니다.]
[오류신고 반론]
0.377로 계산하면 1.846*10^14 이 나옵니다.
5.7*10^12 아닙니다.
[해설작성자 : Rivolo] |
|
| 30. | 다음 염(salt)들 중에서 물에 녹았을 때, 염기성 수용액을 만드는 염을 모두 나타낸 것은? |
 | 4. | NH4Cl, K3PO4, NaCl, NaNO3 |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 76%
| | <문제 해설>
물에 녹았을때 약산의 짝염기가 염기성, 약염기의 짝산은 산성이다.
[해설작성자 : 만거] |
|
| 31. | [표]의 표준 환원 전위를 참고할 때 다음 중 가장 강한 산화제는? |
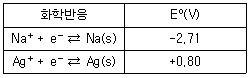
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 86%
| | <문제 해설>
E값이 양수면 환원, 음수면 산화
산화제는 본인이 환원된 것 이므로, Ag+
[해설작성자 : 만거] |
|
| 32. | 산-염기 적정에서 사용하는 지시약이 용액 속에서 다음과 같이 해리한다고 한다. 만일 이 용액에 산을 첨가하여 용액의 액성을 산성이 되게 했다면 용액의 색깔은 어느 쪽으로 변화하는가? |
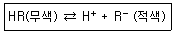
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 81%
| | <문제 해설>
산을 첨가하면 H+가 증가하니 역반응이라 무색
[해설작성자 : 만거] |
|
| 33. | 과산화수소 50wt% 수용액의 밀도가 1.18g/mL 라면 과산화수소수의 몰 농도는 약 몇 M인가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 66%
| | <문제 해설>
100g 가정
H2O2 반 H2O 반
50*1.18 = 59
59/34 = 1.73
1.73/0.1(L) = 17.3
[해설작성자 : 이렇게풀어도 답은나온다] |
|
| 34. | 갈바니 전지를 선 표시법으로 옳게 나타낸 것은? |
| 1. | Cd(d) ║CdCl2(aq)|AgNO3(aq)║Ag(s) |
| 2. | Cd(s)|CdCl2(aq)║AgNO3(aq)|Ag(s) |
| 3. | Cd(s), CdCl2(sq), AgNO3(aq), Ag(s) |
| 4. | Cd(s), CdCl2(ap)|AgNO3(aq), Ag(s) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 89%
|
| 35. | pH 10.00인 10.00mL의 0.0200M Ca2+를 0.0400M EDTA로 적정하고자 한다. 7.00mL EDTA가 첨가되었을 때 Ca2+의 농도는 약 얼마인가? (단, Ca2++EDTA⇄CaY2-, K1=1.8×1010이다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 35%
| | <문제 해설>
Ca^2+ + EDTA -> CaY^2-
Kf = [CaY^2-]/[Ca^2+][EDTA] = 1.8 x 10^10
[Ca^2+] = 0.0200M x 0.0100L = 0.0002mol
[Y^2-] = 0.0400M x 0.00700L = 0.00028mol
Ca^2+ + EDTA -> CaY^2-
초기농도 0.0002 0.00028
반응농도 -0.0002 -0.0002 +0.0002
최종농도 0 0.00008 0.0002
=> Kf = 0.0002/([Ca^2+] x 0.00008) = 1.8 x 10^10
[Ca^2+] = 0.0002/(0.00008x1.8x10^10) = 1.4x 10^-10M
[해설작성자 : 만거] |
|
| 36. | 1.000 Lㆍatmㆍmol-1ㆍK-1을 Jㆍmol-1ㆍK-1로 환산하면 얼마인가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 37. | 다음 중 화학평형에 대한 설명으로 옳은 것은? |
| 1. | 화학평형상수는 단위가 없으며, 보통 K로 표시하고 K가 1보다 크면 정반응이 유리하다고 정의하며, 이 때 Gibbs 자유에너지는 양의 값을 가진다. |
| 2. | 평형상수는 표준상태에서의 물질의 평형을 나타내는 값으로 항상 양의 값이며, 온도에 관계없이 일정하다. |
| 3. | 평형상수의 크기는 반응속도와는 상관이 없다. 즉 평형상수가 크다고 해서 반응이 빠름을 뜻하지 않는다. |
| 4. | 물질의 용해도곱(solubility product)은 고체염이 용액내에서 녹아 성분 이온으로 나뉘는 반응에 대한 평형상수로 흡열반응은 용해도곱이 작고, 발열반응은 용해도 곱이 크다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 81%
| | <문제 해설>
평형상수는 온도만 영향
[해설작성자 : 만거] |
|
| 38. | 갈바니 전지(galvanic cell)의 염다리에 관한 설명 중 틀린 것은? |
| 1. | 염다리는 KCl, KNO3, NH4Cl과 같은 염으로 채워져 있다. |
| 2. | 염다리를 통하여 갈바니 전지는 전체적으로 전기적 중성이 유지된다. |
| 4. | 염다리에는 다공성 마개가 있어 서로 다른 두 용액이 서로 섞이는 것을 방지한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 77%
| | <문제 해설>
3. 매우 높다.
[해설작성자 : 만거] |
|
| 39. | 부피적정에서 사용되는 이상적인 표준용액의 요건이 아닌 것은? |
| 1. | 용액농도가 쉽게 변하지 않는 안정된 물질이여야 한다. |
| 2. | 분석하고자 하는 물질과 빠르게 반응하여야 한다. |
| 3. | 분석 시료 내의 모든 물질과 용이하게 반응하여야 한다. |
| 4. | 분석하고자 하는 물질과 반응하여 반응이 완결되어야 한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 73%
|
| 40. | HCl 용액을 표준화하기 위해 사용한 Na2CO3가 완전히 건조되지 않아서 물이 포함되어 있다면 이것을 사용하여 제조된 CHl 표준용액의 농도는? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 85%
|
| 41. | 푸리에(Fourier) 변환을 이용하는 분광법에 대한 설명으로 틀린 것은? |
| 1. | 기기들이 복사선의 세기를 감소시키기는 광학부분장치와 슬릿을 거의 가지고 있지 않기 때문에 검출기에 도달하는 복사선의 세기는 분산기기에서 오는 것보다 더 크게 되므로 신호-대-잡음비가 더 커진다. |
| 2. | 높은 분해능과 파장 재현성으로 인해 매우 많은 좁은 선들의 겹침으로 해서 개개의 스펙트럼의 특성을 결절하기 어려운 복잡한 스펙트럼을 분석할 수 있게 한다. |
| 3. | 광원에서 나오는 모든 성분 파장들이 검출기에 동시에 도달하기 때문에 전체 스펙트럼을 짧은 시간 내에 얻을 수 있다. |
| 4. | 푸리에 변환에 사용되는 간섭계는 미광의 영향을 받으므로 시간에 따른 미광의 영향을 최소화하기 위하여 빠른 감응검출기를 사용한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 73%
| | <문제 해설>
푸리에 변환에 사용되는 간섭계는 미광의 영향 받지 않는다.
[해설작성자 : 만거] |
|
| 42. | 어떤 물질의 몰흡광계수는 440nm에서 34000M-1cm-1이다. 0.2cm셀에 들어 있는 1.03×10-4M 용액의 퍼센트 투광도 는 약 얼마인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 70%
| | <문제 해설>
A=abc = 34000 x 0.2 x 1.03x10^-4 = 0.7
투광도 T = 10^-A = 10^-0.7 = 0.2
0.2 x 100T = 20%
[해설작성자 : 만거] |
|
| 43. | X-선 분광법은 특정 파장의 X-선 복사선을 방출, 흡수, 회절에 이용하는 방법이다. X-선 분광법 중 결정물질 중의 원자배열과 원자간 거리에 대한 정보를 제공하며, 스테로이드, 비타민, 항생물질과 같은 복잡한 물질구조의 연구, 결정질 화합물의 확인에 주로 응용되고 있는 방법은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 73%
|
| 44. | 양성자 NMR 분광법에서 표준물질로 사용되는 사메틸실란(TMS, Tetramethyl silane)에 대한 설명으로 틀린 것은? |
| 1. | TMS의 가리움 상수가 대부분의 양성자보다 크다. |
| 3. | TMS에 존재하는 모든 양성자는 같은 화학적 이동 값을 갖는다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 61%
| | <문제 해설>
4. 크다.
[해설작성자 : 만거] |
|
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 77%
| | <문제 해설>
3. 감도가 우수하지 않다.
[해설작성자 : 만거] |
|
| 46. | 전자기 복사선의 파장이 긴 것부터 짧아지는 순서대로 옳게 나열된 것은? |
| 1. | 라디오파>적외선>가시선>자외선>X선>마이크로파 |
| 2. | 라디오파>적외선>가시선>자외선>마이크로파>X선 |
| 3. | 마이크로파>적외선>가시선>자외선>라디오파>X선 |
| 4. | 라디오파>마이크로파>적외선>가시선>자외선>X선 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 81%
|
| 47. | Beer의 법칙에 대한 설명으로 옳은 것은? |
| 2. | 몰흡광계수는 특정파장에서 통과한 빛의 양을 의미한다. |
| 3. | 농도가 2배로 증가하면 흡광도는 1/4 로 감소한다. |
| 4. | 흡광도는 시료의 농도와 통로 길이의 단위를 묶어서 % 단위로 표시한다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 63%
|
| 48. | 발광다이오드(LED, Light Emitting Diode)를 적당히 가공하면 반도체 레이저를 제조할 수 있다. 반도체 레이저는 대부분 적외선 영역의 파장을 갖기 때문에 분광학적 응용에는 매우 제한적이다. 따라서 진동수 배가장치를 이용하면 청색, 녹색 등의 파장을 낼 수가 있다. 다음 중 진동 수 배가 장치는? |
| 1. | 비선형 결정(Nonlinear Crystal) |
| 2. | 에셀레 단색화기(Echelle Monochromator) |
| 3. | 광전 증배관(Photomultiplier Tube) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 40%
|
| 49. | 자외선-가시선(UV-Vis) 흡수분광법의 광원의 종류에 해당되지 않는 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
| | <문제 해설>
3번은 원자흡수분광법에 사용
[해설작성자 : 만거] |
|
| 50. | 다음 양자전이 중 가장 큰 에너지가 필요한 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 75%
| | <문제 해설>
내부 전자 > 결합전자 > 분자회전 > 자기장 내에서 핵스핀
내결분자
[해설작성자 : 만거] |
|
| 51. | 안쪽 궤도함수의 전자가 여기상태로 전이할 때 흡수하는 복사선은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 52. | 적외선 흡수 분광법에 사용하는 액체용 시료 용기가 비어 있는 상태에서 1200cm-1~1400cm-1의 구간에서 4개의 간섭봉우리를 나타내었다. 시료 용기의 광로 길이(path length)는 얼마인가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 40%
| | <문제 해설>
시료 용기의 길이 = 봉우리의수 / 2x주파수구간 = 4 / [2x(1400-1200)] = 0.01cm
마이크로미터로 단위 변환 x 10^4 = 100um
[해설작성자 : 만거] |
|
| 53. | 원자분광학에서 사용되는 플라즈마 분석기술과 가장 거리가 먼 것은? |
| 1. | Inductively Coupled Plasma(ICP) |
| 2. | Direct Current Plasma(DCP) |
| 3. | Microwave Induced Plasma(MIP) |
| 4. | Chemical Ionization Plasma(CIP) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 66%
| | <문제 해설>
4는 분자 이온화 장치
[해설작성자 : 만거] |
|
| 54. | 산 무수물(Acid Anhydride)에 대한 적외선 흡수분광 스펙트럼에 대한 설명으로 옳은 것은? |
| 3. | C-H 굽힘 흡수띠는 3,000cm-1 정도에서 발견된다. |
| 4. | C-0신축 흡수띠는 C=0 흡수띠와 유사 위치에 발견된다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 54%
| | <문제 해설>
1. 2개 있음
3. C-H는 1470 ~ 1370cm^-1 에서 나타남
4. C-O는 1250 ~ 1050cm^-1 이며, C=O는 1700cm^-1 이다. 유사하지 않음
[해설작성자 : 만거] |
|
| 55. | 이산화탄소 분자는 모두 몇 개의 기준 진동방식을 가지는가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 79%
| | <문제 해설>
선형이기 때문에
3N - 5 = 4
[해설작성자 : 만거] |
|
| 56. | 불꽃원자장치에서 필요한 구성요소가 아닌 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 62%
|
| 57. | 분석기기를 사용하여 물질을 정량할 때, 적당한 기기분석의 검정법이 아닌 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 70%
| | <문제 해설>
정량분석 검정법 : 표준물첨가법, 내부표준물법, 표준검정곡선법
[해설작성자 : 만거] |
|
| 1. | 특징적인 전이에너지나 흡수파장에 대해 흡광을 하는 원자단을 말한다. |
| 2. | 특징적인 전이에너지를 흡광하지 않지만 인접한 작용기의 흡광세기와 파장에 변화를 주는 치환기이다. |
| 3. | 메틸(Methyl) 그룹은 전형적인 발색단이다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 64%
|
| 59. | 원자흡수법에서 사용되는 광원에 대한 설명으로 틀린 것은? |
| 1. | 다양한 원소를 하나의 광원으로 분석이 가능하다. |
| 2. | 흡수선 나비가 좁기 때문에 분자흡수에서는 볼 수 없는 측정상의 문제가 발생할 수 있다. |
| 3. | 원자 흡수봉우리의 제한된 나비 때문에 생기는 문제는 흡수봉우리보다 저 좁은 띠나비를 갖는 선광원을 사용함으로써 해경할 수 있다. |
| 4. | 원자흡수선이 좁고, 전자전이 에너지가 각 원소마다 독특하기 때문에 높은 선택성을 갖는다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 63%
| | <문제 해설>
1. 원자마다 흡수하는 파장이 다르니 원소별로 각각 광원이 필요하기 때문에 하나의 광원으로는 안된다.
[해설작성자 : 만거] |
|
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
4. 퀴놀린은 접합고리구조를 가지고 있어 형광 발생
[해설작성자 : 만거] |
|
| 61. | 역상(reverse Phase) 액체크로마토그래피에서 용질의 극성이 A>B>C 순으로 감소할 때, 용질의 용출 순서를 빠른 것부터 바르게 나열한 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 78%
| | <문제 해설>
역상 액체크로마토그래피에서 고정상이 비극성이라 이동상이 극성일수록 빨리 용출됨.
[해설작성자 : 만거] |
|
| 62. | 머무름 시간이 630초인 용질의 봉우리 너비를 변곡점을 지나는 접선과 바탕선이 만나는 지점에서 측정해 보니 12초 이었다. 다음의 봉우리는 652초에 용리되었고 너비는 16초 이었다. 두 성분의 분리도는? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 57%
| | <문제 해설>
분리도 = 2(tB - tA) / WA + WB = 2(652-630) / (12+16) = 1.57
[해설작성자 : 만거] |
|
| 63. | 다음 질량분석법 중 시료의 분자량 측정에 이용하기에 가장 부적당한 이온화 방법은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 66%
|
| 64. | 포화칼로멜 전극의 반쪽 전지를 옳게 표현한 것은? |
| 1. | Hg(I)|HgCl2(sat'd), KCl(aq)║ |
| 2. | Hg(s)|HgCl2(sat'd), KCl(aq)| |
| 3. | Hg(s)|KCl(sat'd), Hg2+(aq)║ |
| 4. | Hg(I)|Hg2Cl2(sat'd), KCl(aq)║ |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 56%
|
| 65. | HETP가 50μm인 컬럼의 이론단수가 6500이면 이 컬럼의 최소길이는 얼마인가? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 50%
| | <문제 해설>
H = L/N
=> L = H x N = (50 x 10^-4) x 6500 = 32.5cm
[해설작성자 : 만거] |
|
| 66. | 다음 중 질량분석기로 사용되지 않는 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 58%
| | <문제 해설>
질량분석기 종류 : 이중, 이온, 비행
[해설작성자 : 만거] |
|
| 67. | 플라로그래피법으로 수용액 중의 금속 양이온을 분석하고자 한다. 가장 적합한 작업전극은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 83%
| | <문제 해설>
폴라로그래피 = 적하수은
[해설작성자 : 만거] |
|
| 68. | 전압-전류법의 전압전류고선으로부터 얻을 수 있는 정보가 아닌 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 55%
|
| 69. | 얇은 층 크로마토그래피(TLC)에서 시료 전개 시점부터 전개 용매가 이동한 거리가 7cm, 용질 A가 이동한 거리가 4.5cm라면 지연인자(RF) 값은 얼마인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 73%
| | <문제 해설>
Rf = 시료의 이동거리 / 용매의 이동거리 = 4.5 / 7 = 0.64
[해설작성자 : 만거] |
|
| 70. | 질량분석법에서 기체상태 이온화법이 아닌 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 45%
| | <문제 해설>
빠른원자충격이온화법은 고체시료이다.
[해설작성자 : 진영이] |
|
| 71. | 용액의 비전기전도도(Specific electric conductivity)에 대한 설명 중 틀린 것은? |
| 1. | 용액의 비전기전도도는 이동도에 비례한다. |
| 3. | 용액 중의 이온의 비전기전도도는 하전수에 반비례한다. |
| 4. | 수용액의 비전기전도도는 0.10M KCl용액을 써서 용기상수(Cell constant)를 구해 두면, 측정 전도도값으로부터 계산할 수 있다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 64%
| | <문제 해설>
3. 용액 중의 이온의 비전기전도도는 저항의 역수값을 가진다.
[해설작성자 : 만거] |
|
| 72. | 이온 크로마토그래피에 대한 설명으로 틀린 것은? |
| 1. | 양이온교환 수지에 교환되는 양이온의 교환반응상수는 그 전하와 수화된 이온 크기에 영향을 받는다. |
| 2. | 음이온교환 수지에서 교환상수는 2가 음이온보다 1가 음이온이 더 적은 것이 일반적이다. |
| 3. | 용리액 억제 컬럼은 용리 용매의 이온을 이온화가 억제된 분자화학종으로 변형시켜서 용리 전해질의 전기전도를 막아준다. |
| 4. | 단일 컬럼 이온 크로마토그래피에서는 이온화 억제제를 컬럼에 정지상과 같이 넣어 이온을 분리한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 57%
| | <문제 해설>
4. 이온화 억제제 필요없다.
[해설작성자 : 만거] |
|
| 73. | 다음 표와 같은 열특성을 나타내는 FeCl3ㆍ6H2O 25.0mg을 0℃로부터 340℃까지 가열하였을 때 얻은 열분해 곡선(Thermogram)을 예측하였을 때, 100℃와 320℃에서 시료의 질량으로 가장 타당한 것은? |
 | 1. | 100℃-9.8mg, 320℃-0.0mg |
| 2. | 100℃-12.6mg, 320℃-0.0mg |
| 3. | 100℃-15.0mg, 320℃-15.0mg |
| 4. | 100℃-20.2mg, 320℃-20.2mg |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 67%
| | <문제 해설>
FeCl3 * 6H2O 몰수 : 25.0mg x 1mol/270g x 1g/1000mg = 9.26 x 10^-5mol
feCl3 * 5/2H2O 질량 : (9.26 x 10^-5)mol x 207g/1mol x 1000mg/1g = 19.17mg
FeCl3 질량 : (9.26 x 10^-5)mol x 162g/1mol x 1000mg/1g = 15mg
100도씨는 56도씨 ~ 306도씨 사이라 19.17이하 15이상이다.
320도씨는 15이하이다.
[해설작성자 : 만거] |
|
| 74. | 기체크로마토그래피(GC)에서 정성분석에 이용되는 화합물의 머무름 지수(I, Retention index)가 옳은 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 56%
|
| 75. | 사중극자 질량분석관에서 좁은 띠 필터로 되는 경우는? |
| 3. | 고질량과 저질량 필터가 동시에 작용하는 경우 |
| 4. | 고질량 필터를 먼저 작용시키고, 그다음 저질량 필터를 작용하는 경우 |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 74%
|
| 76. | HPLC에서 GC에서의 온도 프로그래밍을 이용하여 얻은 효과와 유사한 효과를 얻을 수 있는 방법은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 85%
|
| 77. | 질량분석기의 이온화 방법에 대한 설명 중 틀린 것은? |
| 1. | 잔자충격이온화 방법은 토막 내기가 잘 일어나므로 분자량의 결정이 어렵다. |
| 2. | 전자충격이온화 방법에서 분자 양이온의 생성 반응이 매우 효율적이다. |
| 3. | 화학이온화 방법에 의해 얻어진 스펙트럼은 전자충격이온화 방법에 비해 매우 단순한 편이다. |
| 4. | 전자충격이온화 방법의 단점은 반드시 시료를 기화시켜야 하므로 분자량이 1000보다 큰 물질의 분석에는 불리하다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 50%
| | <문제 해설>
2. 해당 생성 반응 거의 일어나지 않는다.
[해설작성자 : 만거] |
|
| 78. | 기준전극(Refernce Electrode)으로 가장 많이 사용되는 전극은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 82%
| | <문제 해설>
2번 전극과 칼로멜전극이 많이 사용됨.
[해설작성자 : 만거] |
|
| 79. | 기체-액체 크로마토그래피법에서 사용되는 운반기체로 가장 거리가 먼 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 78%
|
| 80. | 분자질량 분석법을 활용하여 분석물질의 분자식을 결정하고자 한다. 정수 단위의 질량 차이만을 식별하는 낮은 분해능의 질량분석계를 이용하여 분자식을 결정할 때 사용할 수 있는 가장 유용한 방법은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 61%
| | <문제 해설>
분해능이 낮고 정수단위 질량차이만을 이용하면 동위원소비 분자식 결정
[해설작성자 : 만거] |
|
화학분석기사(구) 필기 기출문제(해설) 및 CBT 2014년09월20일을 이용해 주셔서 감사합니다.
, 필기, 기출문제, 전자문제집, CBT, 온라인, 모의테스트, 모의고사


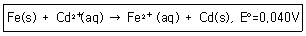
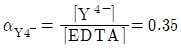 이다.)
이다.)