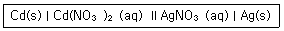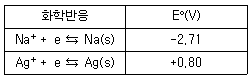위 이미지를 클릭하시면 인터넷으로 바로 문제를 풀어 보실수 있습니다.
(해설, 모의고사, 오답노트, 워드, 컴활, 정보처리 상설검정 프로그램 기능 포함)
전자문제집 CBT란?
종이 문제집이 아닌 인터넷으로 문제를 풀고 자동으로 채점하며 모의고사, 오답 노트, 해설까지 제공하는
무료 기출문제 학습 프로그램으로 실제 상설검정에서 사용하는 OMR 형식의 CBT를 제공합니다.
최신 화학분석기사(구) 필기 기출문제(해설) : [다운로드]
화학분석기사(구) 필기 기출문제(해설) 및 전자문제집 CBT 2017년03월05일| 1. | 어떤 물질의 화학식이 C2H2CIBr로 주어졌고, 그 구조가 다음과 같을 때에 대한 설명으로 틀린 것은? |
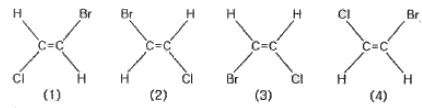 | 3. | (2)와 (3)은 기하 이성질체 관계이다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 89%
| | <문제 해설>
1. (1)과 (2)의 원자 배열이 동일하므로 같은 구조입니다.
2. (2)는 Br과 Cl이 반대편에 있지만, (4)는 같은 쪽에 있으므로 서로 다른 구조입니다.
3. (2)와 (3)은 Br과 Cl의 연결방향만 다른 기하 이성질체 입니다.
4. (3)을 시계방향으로 180도 돌려보면 (4)의 배열이 나오므로 동일구조입니다.
[해설작성자 : 강동우] |
|
| 2. | 어떤 상태에서 탄소(C)의 전자 배치가 1s22s22px2로 나타났다. 이 전자배치에 대하여 옳게 설명한 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 80%
|
| 3. | 어느 실험과정에서 한 학생이 실수로 0.20M NaCI 용액 250mL를 만들었다. 그러나 실제 실험에 필요한 농도는 0.005M 이었다. 0.20M NaCI 용액을 가지고 0.005M NaCI 100mL를 만들려면, 100mL 부피 플라스크에 0.20M NaCI을 얼마나 넣어야 하는가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 83%
| | <문제 해설>
MV = M'V' 이용
0.20 x * = 0.005 x 100
* = 2.5
[해설작성자 : 만거] |
|
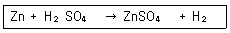
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 90%
|
| 5. | 황산칼슘(CaSO4)의 용해도곱(Ksp)이 2.4×10-5이다. 이 값을 이용하여 황산칼슘(CaSO4)의 용해도를 구하면? (단, 황산칼슘의 분자량은 136.2g이다) |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
| | <문제 해설>
CaSO4 = Ca2+ + SO42-에서
[ca2+][SO42-) = 2.4*10^-5
칼슘이온의 몰농도는 4.9*10^-3이다
M = mol/L를 이용해 g을 구하면 0.667g/L가 나온다
[해설작성자 : 생약분석실 화이팅]
위 해설 화학반응식 참고
[Ca^2+] = * , [SO4^2-] = *
Ksp = [Ca^2+][SO4^2-] = *^2 = 2.4x10^-5
* = 0.004899mol/L
0.004899mol/L x 136.2g/mol = 0.667g/L
[해설작성자 : 만거] |
|
| 6. | 메탄의 연소반응이 다음과 같을 때 CH4 24g 과 반응하는 산소의 질량은 얼마인가? |
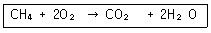
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 78%
| | <문제 해설>
메탄 CH4의 분자량 16
? mol CH4 = 24 / 16 = 1.5 mol
메탄과 산소는 1 : 2 반응 하므로,
산소의 소모량은 1.5 mol x 2 = 3.0 mol
산소의 분자량 32
따라서, 3 mol O2 = 32 X 3 = 96 g
[해설작성자 : 카제로보이] |
|
| 7. | Lewis 구조 가운데 공명구조를 가지는 화합물을 옳게 나열한 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 80%
|
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 88%
| | <문제 해설>
1. 같은 족에서는 주기가 커질수록 이온반지름 커짐.
2. 등전자이온의 반지름은 원자번호가 증가할수록 작아짐.
[해설작성자 : 영산아배구하자] |
|
| 9. | 탄화수소 화합물에 대한 설명으로 틀린 것은? |
| 1. | 탄소-탄소 결합이 단일결합으로 모두 포화된 것을 alkane이라 한다. |
| 2. | 탄소-탄소 결합에 이중결합이 있는 탄화수소 화합물은 alkene 이라 한다. |
| 3. | 탄소-탄소 결합에 삼중결합이 있는 탄화수소 화합물은 alkyne 이라 한다. |
| 4. | 가장 간단한 alkyne 화합물은 프로필렌(C3H4)이다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 91%
|
| 10. | Na2CO3용액에 HCl 용액을 첨가하면 다음과 같은 반응이 진행된다. 이 반응에 근거하여 Na2CO3용액의 몰농도와 노르말농도 사이의 관계를 옳게 나타낸 것은? |
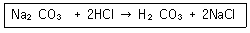
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
노르말농도, N [eq/L] = 몰농도, M [mol/L] X 당량수 [eq/mol]
[해설작성자 : 홍시자격증만개]
Na2CO3는 2당량이다.
노르말농도 = 몰농도 x 당량수 = 0.10 x 2 = 0.20N
[해설작성자 : 만거] |
|
| 1. | 휘발성 용매에 비휘발성 용질이 녹아있는 용액의 끓는점은 순수한 용매보다 높아진다. |
| 2. | 용액은 둘 또는 그 이상의 물질로 이루어진 혼합물이다. |
| 3. | 몰랄농도는 용액 1kg 당 포함된 용질의 몰수를 나타낸다. |
| 4. | 몰농도는 용액 1L당 포함된 용질의 몰수를 나타낸다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 88%
| | <문제 해설>
몰랄농도 : 용매 1Kg 당 포함된 용질의 몰수를 나타낸다
용액이 아니라 용매 기준.
[해설작성자 : neul_] |
|
| 1. | 동적평형에 있는 계에 자극이 가해지면 그 자극의 영향을 최대화하는 방향으로 평형이 변화한다. |
| 2. | 정반응이 발열반응이면 반응온도를 낮추면 평형상수가 증가한다. |
| 3. | 평형상태에 있는 기체 반응혼합물을 압축하면 반응은 기체분자의 수를 감소시키는 방향으로 진행된다. |
| 4. | 촉매는 반응혼합물의 평형조성에 영향을 주지 않는다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 78%
| | <문제 해설>
르 샤틀리에의 법칙에 의해 자극을 받으면 그 자극을 최소화하는 방향으로 평형이 변화하게된다 이겁니다..!
[해설작성자 : 생약분석실 화이팅] |
|
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 92%
|
| 14. | 입체이성질체의 대표적인 2가지 형태 중 하나에 해당하는 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 90%
| | <문제 해설>
입체 이성질체에는 광학 이성질체와 기하 이성질체가 있다.
[해설작성자 : 영산아배구하자] |
|
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 85%
| | <문제 해설>
벤젠은 방향족으로 고리형태지만 헵테인은 c7h16으로 사슬모양 탄화수소이다
[해설작성자 : 소지니지니공주] |
|
| 16. | 철근이 녹이 슬 때 질량은 어떻게 되겠는가? |
| 3. | 녹이 슬면서 일정 시간 질량이 감소하다가 일정하게 된다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 87%
| | <문제 해설>
철이 녹스면서 녹의 무게가 가해져서 질량이 증가
[해설작성자 : 소지니지니공주] |
|
| 17. | 다음 방향족 화합물 구조의 명칭에 해당하는 것은? |

정답 : [1]☜ 블럭 설정하면 보임
정답률 : 91%
|
| 18. | 0.120mol 의 HC2H3O2와 0.140mol 의 NaC2H3O2가 들어 있는 1.00L 용액의 pH를 계산하면 얼마인가? (단, Ka = 1.8×10-5이다) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 73%
| | <문제 해설>
완충용액의 pH 계산
pH = pka + log([짝염기]/[약산])
= -log(1.8 * 0.00001) + log(0.14/0.12)
= 4.812
[해설작성자 : 나오] |
|
| 19. | 0℃, 1atm에서 0.495g 의알루미늄이 모두 반응할 때 발생되는 수소 기체의 부피는 약몇 L 인가? |
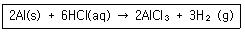
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 71%
| | <문제 해설>
Al의 원자번호 : 13 , 따라서 원자량은 26으로 가정
Al의 몰수 계산 : 0.495 / 26 = 0.0191 mol
Al과 H2의 반응비 = 2 : 3 이므로 Al 2몰 일 때, H2 3몰 생성
따라서 생성된 H2의 몰 수 = 0.0191*3 / 2 = 0.0285
0 도씨, 1atm 에서 1 mol 기체의 부피는 22.4 L
따라서, 22.4 * 0.0285 = 0.634 L = 0.6 L
알루미늄의 원자량을 대략 26으로 가정하였으므로 보기와 소숫점 차이가 발생하였음.
[해설작성자 : 제로보이] |
|
| 20. | 산과 염기에 대한 다음 설명 중 틀린 것은? |
| 1. | 산은 수용액 중에서 양성자(H+, 수소 이온)를 내놓는 물질을 지칭한다. |
| 2. | 양성자를 주거나 받는 물질로 산과 염기를 정의하는 것은 브뢴스테드에 의한 산염기의 개념이다. |
| 3. | 산과 염기의 세기는 해리도를 통해 가늠할 수 있다. |
| 4. | 아레니우스에 의한 산의 정의는 물에서 해리되어 수산화 이온을 내놓는 물질이다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 88%
| | <문제 해설>
아레니우스 산: 물 속에서 수소이온(H+)을 내놓는 물질
아레니우스 염기 : 물 속에서 수산화이온(OH-)을 내놓는 물질
[해설작성자 : 영산아배구하자] |
|
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 84%
| | <문제 해설>
SI 단위
m(미터), kg, s(초), A(암페어), K(켈빈), mol
[해설작성자 : 나오] |
|
| 22. | 0.10M NaCl 용액 속에 PbI2가 용해되어 생성된 Pb2+(원자량 207.0g/mol) 농도는 약 얼마인가? (단, PbI2의 용해도곱상수는 7.9×10-9이고 이온세기가 0.10M 일 때 Pb2+과 I-의 활동도계수는 각각 0.36과 0.75이다.) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 42%
| | <문제 해설>
PbI2 -> Pb^2+ + 2I-
* *^2
Ksp = [Pb^2+][I-]^2 = (*x0.36)(2*x0.75)^2
7.9x10^-9 = (*x0.36)(2*x0.75)^2
* = 2.14x10^-3 => [Pb^2+] = 2.14x10^-3mol/L
2.14x10^-2mol/L x 207.0g/mol x 1000mg/g = 443mg/L
[해설작성자 : 만거] |
|
| 23. | 칼슘이온 Ca2+을 무게분석법을 활용하여 정량하고자 한다. 이 때 효과적으로 사용할 수 있는 음이온은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 69%
| | <문제 해설>
칼슘이온은 (C2O4)2- 랑 침전물을 생성하기 때문에
[해설작성자 : 김정우 보고싶어]
1. 매우 잘 용해되지 않음 mg단위
2. SO4 2-와도 침전물을 형성합니다.(잘 용해되지 않음 g단위)
3. 잘 용해됨
4. 잘 용해됨.
그래서 1번이 답인 겁니다.
[해설작성자 : Rivolo] |
|
| 24. | HCl 용액을 표준화하기 위해 사용한 Na2CO3가 완전히 건조되지 않아서 물이 포함되어 있다면 이것을 사용하여 제조된 HCl 표준용액의 농도는? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 81%
|
| 25. | 다음 중 화학평형에 대한 설명으로 옳은 것은? |
| 1. | 화학평형상수는 단위가 없으면, 보통 K로 표시하고 K가 1보다 크면 정반응이 유리하다고 전의하며, 이때 Gibbs 자유에너지는 양의 값을 가진다. |
| 2. | 평형상수는 표준상태에서의 물질의 평형을 나타내는 값으로 항상 양의 값이며, 온도에 관계없이 일정하다. |
| 3. | 평형상수의 크기는 반응속도와는 상관이 없다. 즉, 평형상수가 크다고 해서 반응이 빠름을 뜻하지 않는다. |
| 4. | 물질의 용해도곱(solubility product)은 고체염이 용액 내에서 녹아 성분 이온으로 나뉘는 반응에 대한 평형상수로 흡열반응은 용해도곱이 작고, 발열반응은 용해도곱이 크다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 80%
|
| 26. | 화학평형상수 값은 다음 변수 중에서 어느 값의 변화에 따라 변하는가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 69%
| | <문제 해설>
답은 온도! 화학평형상수 값은 촉매 압력 농도에 무관하고 온도에만 의지한다
[해설작성자 : 진재] |
|
| 27. | 일차 표준물질(primary standard)에 대한 설명으로 틀린 것은? |
| 2. | 시약의 무게를 재면 곧바로 사용할 수 있을 정도로 순수하다. |
| 4. | 가열이나 진공으로 건조시킬 때 불안정하다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 85%
| | <문제 해설>
분석화학에서 일차 표준 물질 (영어: primary standard)이란, 순도가 높고 용액을 만들었을 시 무게 오차가 적어 예상한 농도와 거의 동일한 농도의 용액을 만들 수 있는 물질을 말한다.
일차 표준 물질이 되기 위한 조건으로는
1. 정제하기 쉬워야 한다.
2. 흡수, 풍화, 공기 산화 등의 성질이 없고 오랫동안 보관하여도 변질되지 않아야 한다.
3. 반응이 정량적으로 진행되어야 한다.
4. 되도록 당량 중량이 커서 측량 오차를 감소시킬 수 있어야 한다.
출처 위키백과
[해설작성자 : 나오] |
|
| 28. | 다음 각각의 용액에 1M의 HCl을 2mL씩 첨가하였다. 어떤 용액이 가장 작은 pH 변화를 보이겠는가? |
| 3. | 0.1M NaOH 30mL와 0.1M CH3COOH 30mL 의 혼합용액 |
| 4. | 0.1M NaOH 30mL와 0.1M CH3COOH 60mL의 혼합용액 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 63%
| | <문제 해설>
4번이 약산과 그 짝염기가 존재해 완충용액 역할을 수행한다. 완충용액에서 pH변화가 가장 작다.
[해설작성자 : 만거] |
|
| 29. | 2.00μmol의 Fe2+이온이 Fe3+이온으로 산화되면서 발생한 전자가 1.5V의 전위차를 가진 장치를 거치면서 수행할 수 있는 최대일의 양은 약 몇 J 인가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 56%
| | <문제 해설>
W=Q×V
Q=n×F
F=96500C/mol
n=2×10^-6mol
V=1.5V
따라서 W=96500×(2×10^-6)×1.5=0.29J |
|
| 30. | EDTA(etylenediaminetetraacetic acid, H4Y)를 이용한 금속 Mn+적정으로 조건 형성상수(conditional formation constant) Kf´ 에 대한 설명으로 틀린 것은? (단, Kf는 형성상수이다.) |
| 1. | EDTA(H4Y)화학종중 [Y4-]의 농도 분율을 αY4-로 나타내면, αY4-=[Y4-]/[EDTA]이고 Kf´=αY4-Kf이다. |
| 2. | Kf´ 는 특정한 pH에서 MYn-4의 형성을 의미한다. |
| 3. | Kf´ 는 pH가 높을수록 큰 값을 갖는다. |
| 4. | Kf´ 를 이용하면 해리된 EDTA의 각각의 이온농도를 계산할 수 있다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 63%
| | <문제 해설>
4. Y^4-의 이온농도는 계산할 수 있지만 다른 이온들은 계산할 수 없다.
[해설작성자 : 만거] |
|
| 31. | 산화ㆍ환원 지시약에 대한 설명 중 틀린 것은? (단, E°는 표준환원전위, n은 전자수이다.) |
| 1. | 지시약은 주로 이중 결합들이 콘주게이션(conjugated)된 유기물이다. |
| 2. | 변색범위는 주로  이다. 이다. |
| 3. | 당량점에서의 전위와 지시약의 표준환원전위(E°)가 비슷한 것을 사용해야 한다. |
| 4. | 분석하고자 하는 이온과 결합했을 때 산화된 상태와 환원된 상태의 색이 달라야 한다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 82%
| | <문제 해설>
2. E= Eo +(-) 0.05916/n (V)
[해설작성자 : 만거] |
|
| 32. | 20.00mL의 0.1000M Hg22+를 0.1000M Cl-로 적정하고자 한다. Cl-를 40.00mL 첨가 하였을 때, 이 용액 속에서 Hg22+의 농도는 약 얼마인가? (단, Hg2Cl2(s) ⇆ Hg22+(aq) +2Cl-(aq), KSP=1.2×10-18이다.) |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 61%
| | <문제 해설>
Hg2Cl2(s) ⇆ Hg2^2+(aq) +2Cl-(aq)
[Hg2^2+]=x 일 때 [Cl-]=2x 로 비율이 1:2
Hg2^2+의 몰수는 0.1000M×20.00ml=2.000mmol
Cl-의 몰수는 0.1000M×40.00ml=4.000mmol
비율이 1:2 이므로
앙금이 되어 석출이 되어도 비율은 1:2
Ksp=[Hg2^2+][Cl-]^2=1.2×10^-18=(x)(2x)^2
x=6.7×10^-7
[해설작성자 : 제이마리러버] |
|
| 33. | 다음 중 KMnO4와 H2O2의 산화환원 반응식을 바르게 나타낸 것은? |
| 1. | MnO4- + 2H2O2 + 4H+ → MnO2 + 4H2O + O2 |
| 2. | 2MnO4- + 2H2O2 → 2MnO + 2H2O + 2O2 |
| 3. | 2MnO4- + 5H2O2 + 6H+ → 2Mn2+ + 8H2O + 5O2 |
| 4. | 2MnO4- + 5H2O2 → 2Mn2+ + 5H2O +13/2 O2 |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 75%
|
| 34. | 다음 표에서 약 염기성 용액을 강산 용액으로 적정할 때 적합한 지시약과 적정이 끝난 후에 용액의 색깔을 옳게 나타낸 것은? |

정답 : [1]☜ 블럭 설정하면 보임
정답률 : 83%
|
| 35. | 다음과 같은 선표기법으로 나타내어진 전기화학전지에 관한 설명으로 틀린 것은? |
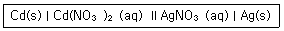 | 4. | 이 전지에서 전자는 Cd(s)로부터 나와서 Ag(s)로 이동한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 87%
| | <문제 해설>
염다리표시는 ll로 하나이다.
[해설작성자 : 신쫄이 레콜맛] |
|
| 36. | 금속착화합물(metal complex)에서 금속이온과 리간드간의 결합 형태는 무엇인가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 82%
|
| 37. | 증류수에 Hg2IO3)2로 포화시킨 용액에 KNO3 같은 염을 첨가하면 용해도가 증가한다. 이를 설명할 수 있는 요인으로 가장 적합한 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 45%
| | <문제 해설>
용해도가 증가한다는 것은 이온간의 상호작용이 증가하는 것이기 때문에, 이온세기가 정답이다.
[해설작성자 : 김정우 보고싶어] |
|
| 38. | EDTA 적정 시 pH가 높은 경우에는 EDTA를 넣기 전에 수산화물인 M(OH)n전물이 형성되는 경우가 있으며 이런 경우에는 많은 오차가 발생한다. 다음 중 이를 방지하기 위한 가장 적절한 방법은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 75%
|
| 39. | 다음 [표]의 표준 환원 전위를 참고할 때 다음 중 가장 강한 산화제는? |
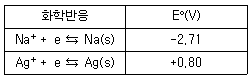
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 82%
|
| 40. | 25℃에서 100mL의 물에 몇 g의 Ag3AsO4가 용해될 수 있는가? (단, 25℃에서 Ag3AsO4의 Ksp=1.0×10-22, Ag3AsO4의 분자량 : 462.53g/mol이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 48%
| | <문제 해설>
Ksp=1.0×10^-22=[Ag+]^3[AsO4^3-]
[Ag+]=3x 일 때, [AsO4^3-]=x
Ksp=(3x)^3(x)=27x^4
x=1.387×10^-6(M)
1.387×10^-6M×462.53g/mol
=6.42×10^-4g/L
100ml에는 6.42×10^-5g
[해설작성자 : 제이마리러버] |
|
| 41. | NMR 기기에서 표준물로 사용되는 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 89%
|
| 42. | 다음 보기에서 삼중결합 진동모드를 관찰할 수 있는 분자는? |
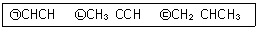
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 53%
| | <문제 해설>
진동모드를 관찰하기 위해서는 쌍극자모멘트의 변화가 있어야하는데 아세틸렌(HCCH)의 경우 대칭형이기때문에 진동모드가 관찰되지 않는다.
[해설작성자 : 가르이온] |
|
| 43. | 양성자와 13C 원자사이에 짝풀림을 하는 여러 가지 방법이 있다. 13C NMR에 이용하는 짝풀림이 아닌 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 62%
| | <문제 해설>
13C NMR 양성자 짝풀림
- 넓은 띠 짝풀림
- 공명 비킴 짝풀림
- 펄스법 짝풀림
- 핵의 Overhauser 효과
[해설작성자 : 만거] |
|
| 44. | 나트륨 D라인의 파장은 589nm이다. 이 광선이 굴절률 1.09인 매질을 지날 때 ㉠이 광선의 에너지, ㉡주파수(frequency)를 각각 구한 값으로 옳은 것은? (단, 프랭크상수 h = 6.627×10-34Jㆍsec, 광속 с=2.99×108m/sec이다.)(오류 신고가 접수된 문제입니다. 반드시 정답과 해설을 확인하시기 바랍니다.) |
| 1. | ㉠3.66×10-19J, ㉡6.04×1014Hz |
| 2. | ㉠3.66×10-19J, ㉡5.54×1014Hz |
| 3. | ㉠3.36×10-19J, ㉡5.08×1014Hz |
| 4. | ㉠3.36×10-19J, ㉡4.66×1014Hz |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 52%
| | <문제 해설>
E = hv = hc/파장
= 6.627 x 10^-34J*s x (2.99x10^8m/s)/589nm x 10^9nm/m = 3.36x10^-19J
v = E/h = 3.36x10^-19 / 6.627x10^-34 = 5.08x10^14 Hz
[해설작성자 : 만거] |
|
| 45. | 광학기기의 구성이 각 분광법과 바르게 짝지어진 것은? |
| 1. | 흡수분광법 ; 시료→파장선택기→검출기→기록계→광원 |
| 2. | 형광분광법 ; 광원→시료→파장선택기→검출기→기록계 |
| 3. | 인광분광법 ; 광원→시료→파장선택기→검출기→기록계 |
| 4. | 화학발광법 ; 광원과 시료→파장선택기→검출기→기록계 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 74%
|
| 46. | 분광분석기기에서 단색화 장치에 대한 설명으로 가장 거리가 먼 것은? |
| 1. | 연속적으로 단색광의 빛을 변화하면서 주사하는 장치이다. |
| 2. | 분석하려는 성분에 맞는 광을 만드는 역할을 한다. |
| 3. | 필터, 회절발 및 프리즘 등을 사용한다. |
| 4. | 슬릿은 단색화장치의 성능특성과 품질을 결정하는데 중요한 역할을 한다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 48%
| | <문제 해설>
2. 단색화 장치는 특정 파장을 가진 단색광 추출하는 역할.
[해설작성자 : 만거] |
|
| 47. | NMR 스펙트럼의 1차 스펙트럼 해석에 대한 규칙의 설명으로 틀린 것은? |
| 1. | 동등한 핵들은 다중 흡수 봉우리를 내주시 위하여 서로 상호작용하지 않는다. |
| 2. | 짝지움 상수는 네 개의 결합길이보다 큰 거리에서는 짝지움이 거의 일어나지 않는다. |
| 3. | 띠의 다중도는 이웃 원자에 있는 자기적으로 동등한 양성자의 수(n)dp 의해 결정되며, n으로 주어진다. |
| 4. | 짝지움 상수는 가해준 자기장에 무관하다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 57%
| | <문제 해설>
n+1로 주어진다
[해설작성자 : 만거] |
|
| 48. | 어떤 금속(M)-리간드(L) 착화합물의 해리는 다음과 같이 진행된다. (전하 생략) : ML2 > M + 2LM농도가 2.30×10-5M이고 과량의 L을 가하여 모든 M이 착물(ML2)로 존재할 때 흡광도(A)가 0.780이었다. 같은 양의 M을 화학양론적 양의 L과 혼합한 용액의 흡광도(A)가 0.520이었다면 이 때, 착화합물의 해리도(%)는 얼마인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 36%
| | <문제 해설>
b는 시료셀의 길이인데 1로 가정합니다. A = abc
0.780 = a x 1 x 2.30x10^-5 -> a = 33913.0434
0.520 = 33913.0434 x 1 x c' -> c' = 1.53x10^-5\
해리도(%) = (Co - C'/Co)x100% = (2.30x10^-5 - 1.53x10^-5 / 2.30x10^-5)x100% = 33.5%
[해설작성자 : 만거] |
|
| 49. | 불꽃 원자화와 비교한 유도결합 플라스마 원자화에 대한 설명으로 옳은 것은? |
| 1. | 이온화가 적게 일어나서 감도가 더 높다. |
| 2. | 자체흡수효과가 많이 일어나서 감도가 더 높다. |
| 3. | 자체반전효과가 많이 일어나서 감도가 더 높다. |
| 4. | 고체상태의 시료를 그대로 분석할 수 있다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 63%
| | <문제 해설>
ICP 원자화
-높은 온도에 머물러 원자화가 잘 일어나고 화학적 방해도 거의 없다.
- 플라스마 단면의 온도분포가 균일해 자체흡수와 자체반전효과가 없다.
- 아르곤의 이온화로 생긴 전자농도가 시료성분의 이온화로 생기는 전자농도에 비해 커서 이온화에 의한 방해효과가 적다.
[해설작성자 : 만거] |
|
| 50. | 원자 분광법에서 용액 시료의 도입 방법이 아닌 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 74%
| | <문제 해설>
원자 분광법에서 용액 상태의 시료의 도입방법에는 기체 분무화, 초음파 분무화, 전열증기화, 수소화물 생성법이 있다.
[해설작성자 : 개굴개구리]
글로우 방전법은 전도성 고체 도입방법이다.
[해설작성자 : 합격하고싶어요] |
|
| 51. | 불꽃, 전열, 플라스마 원자화 장치의 특징에 대한 설명으로 틀린 것은? |
| 1. | 플라스마의 경우 원자화 온도는 보통 4000~6000℃ 정도 이다. |
| 2. | 불꽃원자화는 재현성은 좋으나 시료효율, 감도는 좋지 않다. |
| 3. | 전열원자화 장치가 불꽃 원자화 장치보다 많은 양의 시료를 필요로 한다. |
| 4. | 전열원자화 장치의 경우 중앙에 구멍이 있는 원통형 흑연관에서 원자화가 일어난다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 71%
| | <문제 해설>
전열원자화 장치는 원자가 빛 진로에 평균적으로 머무는 시간이 길어 감도가 높고, 적은 양의 시료로 좋은 결과를 도출할 수 있다.
[해설작성자 : 공화] |
|
| 52. | 다음 1H-핵자기공명(NMR)스펙트럼의 화학적 이동(chemical shift)에 대한 설명 중 옳지 않은 것은? |
| 1. | 외부자기장 세기가 클수록 화학적이동(δ, ppm)은 커진다. |
| 2. | 가리움이 적을수록 낮은 자기장에서 봉우리가 나타난다. |
| 3. | 300MHz NMR로 얻은 화학적이동(Hz)은 200MHz NMR로 얻은 화학적이동(Hz)보다 크다. |
| 4. | 화학적 이동은 편재 반자기 전류효과 때문에 나타난다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 50%
| | <문제 해설>
1. 외부자기장 세기가 클수록 화학적이동은 작아진다.
[해설작성자 : 만거] |
|
| 53. | 0.5nm/mm의 역선 분사능을 갖는 회절발 단색화 장치를 사용하여 480.2nm와 480.6nm의 스펙트럼선을 분리하려면 이론상 필요한 슬릿나비는 얼마인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 39%
| | <문제 해설>
1/2 x (480.6-480.2) = 0.2
0.2/0.5 = 0.4
[해설작성자 : 만거] |
|
| 54. | 원자 X선 분광법 중 고체 시료에 들어 있는 화합물에 대한 정성 및 정량적인 정보를 제공해 주고, 결정성 물질의 원자 배열과 간격에 관한 정보를 제공해 주는 방법은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 78%
| | <문제 해설>
결정성 물질의 원자 배열과 간격을 보여주는 것은 x선 화절법이다.
[해설작성자 : 은보라] |
|
| 4. | photo-conducing detector |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 53%
| | <문제 해설>
PDA는 광다이오드 검출기로 uv-vis 검출기이다
[해설작성자 : 생약분석실화이팅] |
|
| 56. | 형광(Fluorescence)에 대한 설명으로 가장 옳은 것은? |
| 2. | pyridine, furan 등 간단한 헤테로 고리화합물은 접합고리구조를 갖는 화합물보다 형광을 더 잘 발생한다. |
| 3. | 전형적으로 형광은 수명이 약 10-10~10-5s 정도이다. |
| 4. | 250nm이하의 자외선을 흡수하는 경우에 형광을 방출한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 66%
| | <문제 해설>
1. 해당 전이에서 형광 거의 없음
2. 간단한 헤테로 화합물은 형광 발생 안함. 접합고리구조를 갖는 화합물이 형광을 발생한다.
4. 형광 방출 거의 안함.
[해설작성자 : 만거] |
|
| 57. | 원자분광법에서 원자선 나비는 여러 가지요인들에 의해서 넓힘이 일어난다. 선 넓힘의 원인이 아닌 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 66%
| | <문제 해설>
원자선 너비의 선 넓힘 원인
- 불확정성 효과
- 도플러 효과
- 원자들과의 충돌에 의한 압력효과
- 전기장과 자기장 효과
[해설작성자 : 만거] |
|
| 58. | 빛의 흡수와 발광(luminescence)을 측정하는 장치에서 두드러진 차이를 보이는 분광기 부품은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 66%
|
| 59. | 어떤 분자가 S1상태로부터 형광 빛을 내놓고(fluoresce), T1상태로부터 인광 빛을 내놓는다(phosphoresce). 다음 설명 중 옳은 것은? |
| 2. | 형광파장보다 인광파장이 흡수파장에 가깝다. |
| 3. | 한 분자에서 나오는 빛이므로 잔광시간(decaytime)은 유사하다. |
| 4. | 인광의 잔광시간이 형광의 잔광시간보다 일반적으로 짧다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 58%
| | <문제 해설>
2. 형광파장이 가깝다.
3,4 : 인광의 잔광시간이 형광보다 길다.
[해설작성자 : 만거] |
|
| 60. | 순수한 화합물 A를 녹여 정확히 10mL의 용액을 만들었다. 이 용액 중 1mL를 분취하여 100mL로 묽힌 후 250nm에서 0.50cm의 셀로 측정한 흡광도가 0.432이었다면 처음 10mL 중에 있는 시료의 몰농도는? (단, 몰 흡광계수(ε)는 4.32×103M-1cm-1이다.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 55%
| | <문제 해설>
흡광도=εbc
0.432=(4.32×10^3)(0.50)c
c=0.0002
100배 묽혀진 농도이므로
초기 몰농도는
0.0002×100=0.02
[해설작성자 : 제이마리러버] |
|
| 61. | 다음 이성질체 혼합물 중 키랄 정지상 관으로만 분리가 가능한 혼합물질은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 73%
|
| 62. | 카드늄 전극이 0.0150M Cd+2용액에 담구어진 경우 반쪽전지의 전위를 Nernst식을 이용하여 구하면 약 몇 V인가? |

정답 : [3]☜ 블럭 설정하면 보임
정답률 : 75%
| | <문제 해설>
E=Eo-(0.0592/n)log(1/[Cd2+])
=-0.403-(0.0592/2)log(1/0.0150)
=-0.457
[해설작성자 : 제이마리러버] |
|
| 63. | HPLC의 검출기에 대한 설명으로 옳은 것은? |
| 1. | UV 흡수 검출기는 254nm의 파장만을 사용한다. |
| 2. | 굴절율 검출기는 대부분의 용질에 대해 감응하나 온도에 매우 민감하다. |
| 3. | 형광검출기는 대부분의 화학종에 대해 사용이 가능하나 감도가 낮다. |
| 4. | 모든 HPLC 검출기는 용액의 물리적 변화만을 감응한다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 64. | 전위차법에서 지시전극은 분석물의 농도에 따라 전극전위의 값이 변하는 전극이다. 지시전극에는 금속 지시전극과 막 지시전극이 있다. 다음 중 막 지시전극에 해당하는 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 65. | 전위차 적정법에 대한 설명으로 틀린 것은? |
| 1. | 서로 다른 해리도를 갖는 산 또는 염기성 용액의 혼합물을 적정하여 각 화합물의 당량점을 측정할 수 있다. |
| 2. | 알맞은 지시약이 없는 경우, 착색용액이나 비용매 중에서 적정 당량점을 찾을 수 있다. |
| 3. | 전위차법은 침전적정법, 착화적정법에 응용할 수 있다. |
| 4. | 지시약을 전위차법과 함께 사용하면 종말점 예상이 어려워진다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 83%
| | <문제 해설>
4. 지시약을 전위차법과 함께 사용하면 종말점 예상이 쉬워진다.
[해설작성자 : 만거] |
|
| 66. | 전자충격법에 의한 질량분석법으로 물질을 분석할 때 분자 이온의 안정도가 가장 작을 것이라고 생각되는 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 51%
| | <문제 해설>
분자이온의 안정도가 가장 작은 물질 > 알코올
[해설작성자 : 19학번멋쟁이] |
|
| 67. | 모세관 전기이동을 이용하여 시료를 분리하는 주요 원인은 다음 중 어느 것인가? |
| 2. | 모세관 내부에 충전된 고정상에 의한 분리효과 |
| 3. | 고전압에 의한 분리관 내 수소이온 농도의 기울기에 의한 분리 |
| 4. | 모세관에 연결된 고전압 전극의 힘에 의하여 끌려가는 힘 |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 63%
|
| 68. | 액체크로마토그래피에서 분리효율을 높이고 분리시간을 단축시키기 위해 기울기용리법(gradient elution)을 사용한다. 이 방법에서는 용매의 어떤 성질을 변화시켜 주는가? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 81%
|
| 69. | 백금(Pt)전극을 써서 수소이온을 발생시키는 전기량 적정법으로 염기수용액을 정량할 때 전해용액으로서 적당한 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 69%
|
| 70. | 기체크로마토그래피법에서의 시료의 주입방법은 크게 분할주입과 비분할주입으로 나뉜다. 다음 중 분할주입(split injection)에 대한 설명이 아닌 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 57%
| | <문제 해설>
분할주입은 고농도 분석물질 및 기체시료에 적합하다.
분리도가 좋고 불순물이 많은 시료를 다룰 수 있지만, 열적으로 불안정해 350도 이상의 온도를 유지해야한다.
[해설작성자 : 만거] |
|
| 71. | [그래프]는 항생제 클로람페니콜(RNO2) 2mM용액의 순환전압전류곡선이다. 0.0V에서 주사를 시작하여 피크 A를 얻었고, 이어서 B와 C를 순서대로 얻었다. 이 피크들이 나타나는 이유는 다음과 같다. 다음 설명 중 틀린 것은? |
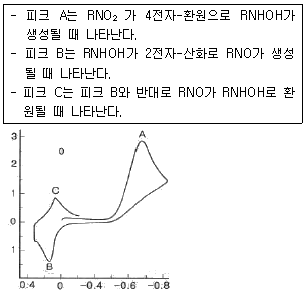 | 2. | 0.4V에서 주사를 시작하면 피크 C가 첫 번째로 나타난다. |
| 3. | 반대 방향으로 주사를 시작하면, 피크 B는 나타나지 않는다. |
| 4. | 10회 전압 순환동안 피크 B의 크기는 변하지 않는다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 59%
|
| 72. | 용액 중 이온들이 전극표면으로 이동하는 주요 과정이 아닌 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 65%
|
| 73. | 기체크로마토그래피 검출기 중 니켈-63(63Ni)과 같은 β-선 방사체를 사용하며, 할로겐과 같은 전기 음성도가 큰 작용기를 지닌 분자에 특히 감도가 좋고 시료를 크게 변화시키지 않는 검출기는? |
| 1. | 불꽃 이온화 검출기(FID; flame ionization detector) |
| 2. | 전자 포착 검출기(ECD; electron capture detector) |
| 3. | 원자 방출 검출기(AED; atomic emission detector) |
| 4. | 열전도도 검출기(TCD; thermal conductivity detector) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 82%
| | <문제 해설>
전자 포착 검출기(ECD)는 할로겐 원소에 대한 감응선택성이 우수한 검출기이다.
[해설작성자 : 공화] |
|
| 74. | 10cm 관에 물질 A와 B의 분리 할 때 머무름 시간은 각각 10분과 12분이고, A와 B의 봉우리 나비는 각각 1.0분과 1.1분이다. 관의 분리능을 계산하면? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 71%
| | <문제 해설>
분리능=(머무름시간 차)÷(봉우리나비평균)
=(12-10)/[(1.1+1.0)/2]
=1.9
[해설작성자 : 제이마리러버] |
|
| 75. | 시차주사 열량법(differential scanning calorimetry, DSC)에서 시료온도를 일정한 속도로 변화시키면서 시료와 기준으로 흘러들어오는 열 흐름의 차이가 측정되는 기기장치는? |
| 1. | 전력-보상 DSC기기(power-compensated DSC instrument) |
| 2. | 열-플럭스 DSC기기(heat-flux DSC instrument) |
| 3. | 변조 DSC기기(modulated DSC instrument) |
| 4. | 시차 열 분석기기(differential thermal analytical instrument) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 57%
|
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
열무게 측정장치의 구성
: 열저울, 전기로, 시료 잡이, 기체 주입장치, 컴퓨터
[해설작성자 : 만거] |
|
| 77. | 벗김 분석(Stripping Method)이 감도가 좋은 이유는? |
| 1. | 전극을 커다란 수은방울을 사용하기 때문이다. |
| 2. | 농축단계에서 사전에 전극에 금속이온을 농축하기 때문이다. |
| 4. | 전극의 전위를 빠른 속도로 주사하기 때문이다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 78. | 유도결합 플라스마(ICP) 원자방출 광원장치는 원자 방출 및 질량분석기와 결합하여, 금속의 정성 및 정량에 많이 사용되고 있다. 이 ICP에 대한 설명으로 틀린 것은? |
| 1. | 무전극으로 광원을 발생시켜, 기존의 다른 방출광원보다 오염가능성이 적다 |
| 2. | 불활성 기체를 사용하여 광원을 발생시켜, 산화물 분자들의 간섭을 줄였다. |
| 3. | 상대적으로 이온이 많이 발생하여, 쉽게 이온화되는 원소들에 의한 영향이 크다. |
| 4. | 고온으로서 원자화 및 여가상태로 만드는 효율이 높다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 69%
| | <문제 해설>
ICP는 이온화에 대한 방해효과가 거의 없다. (아르곤의 이온화때문)
자체흡수와 자체반전 효과가 나타나지 않는다.
원자의 수명 김.
[해설작성자 : 만거] |
|
| 79. | Van Deemter 식으로부터 얻을 수 있는 가장 유용한 정보는 무엇인가? |
| 1. | 이동상의 적절한 유속(flow rate)을 알 수 있다. |
| 2. | 정지상의 적절한 온도(temperature)를 알 수 있다. |
| 3. | 선택계수(α, selectivity coefficient)를 알 수 있다. |
| 4. | 분석물질의 머무름 시간(retention time)을 알 수 있다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 80%
|
| 80. | 분자량이 50.00 과 50.01 인 물질을 질량분석기에서 분리하기 위하여 최소한 어느 정도의 분리능을 가진 질량분석기를 사용해야 하는가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 73%
| | <문제 해설>
질량분석기의 분리능(R)에 대해 R=m/Δm (m: 봉우리가 생기는 명목상의 질량, Δm: 분리된 두 봉우리 사이의 질량차이)
R=50.00/(50.01-50.00)=5000
[해설작성자 : 개굴개구리] |
|
화학분석기사(구) 필기 기출문제(해설) 및 CBT 2017년03월05일을 이용해 주셔서 감사합니다.
, 필기, 기출문제, 전자문제집, CBT, 온라인, 모의테스트, 모의고사


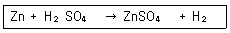
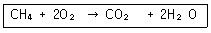
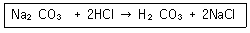

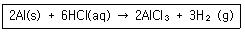
 이다.
이다.