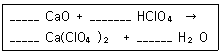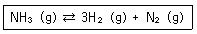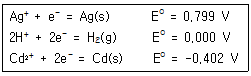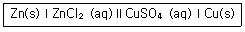위 이미지를 클릭하시면 인터넷으로 바로 문제를 풀어 보실수 있습니다.
(해설, 모의고사, 오답노트, 워드, 컴활, 정보처리 상설검정 프로그램 기능 포함)
전자문제집 CBT란?
종이 문제집이 아닌 인터넷으로 문제를 풀고 자동으로 채점하며 모의고사, 오답 노트, 해설까지 제공하는
무료 기출문제 학습 프로그램으로 실제 상설검정에서 사용하는 OMR 형식의 CBT를 제공합니다.
최신 화학분석기사(구) 필기 기출문제(해설) : [다운로드]
화학분석기사(구) 필기 기출문제(해설) 및 전자문제집 CBT 2006년09월10일| 1. | 슈크로오스(C12H22O11)는 우리가 흔히 먹는 설탕으로, 글루코오스와 프락토오스에서 물 한 분자가 제거되면서 결합되어 생성된 이당류이다. 슈크로오스 684g 을 물에 녹여 전체부피를 4.0L로 만들었을 때 이 용액의 몰농도(M)는 얼마인가? (단, 슈크로오스의 분자량은 342로 가정하시오.) |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 89%
| | <문제 해설>
몰농도 = [용질의 몰수] / [용액의 부피] = mol/L = M
슈크로오스의 몰수 = 684g * (1mol / 342g) = 2mol
용액의 부피 = 4.0L
슈크로오스의 몰농도 = 2mol / 4.0L = 0.50 mol/L = 0.50M
[해설작성자 : 구운감자] |
|
| 2. | 티오시아네이트(Thiocyanate) 이온(SCN-)의 정확한 구조는 어느것인가? |
| 1. |  |
| 2. |  |
| 3. |  |
| 4. |  |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 86%
|
| 3. | 다음 물질의 Ka 값이 아래와 같을 때, 다음 중 염기의 세기가 가장 큰 것은? |
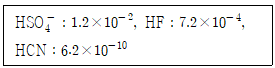
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 73%
| | <문제 해설>
산의 세기가 작을수록 염기의 세기는 강하다. Ka(산의세기)가 가장 작은 CN-이 정답.
[해설작성자 : 킹떡만] |
|
| 1. | 특별한 조건에서 용액의 최대 용해도를 초과한 용액을 과포화 되었다고 한다. |
| 2. | 어떤 주어진 온도에서 최대로 녹을 수 있는 용질의 양을 포함하는 용액을 포화 되었다고 한다. |
| 3. | 일반적으로 고체화합물의 용해도는 용액의 온도가 올라가면 감소한다. |
| 4. | 용액의 농도가 용액의 최대 용해도보다 적을 때는 불포화 되었다고 한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 88%
| | <문제 해설>
용해도는 온도가 증가할 수록 증가합니다.
[해설작성자 : 승현] |
|
| 5. | 반쪽 반응식을 이용하여 산화환원반응의 계수를 맞추는 방법에 대한 설명 중 틀린 것은? |
| 1. | 산화 및 환원 반쪽반응의 원자량을 맞춘다. |
| 3. | 계수를 사용하여 각 반쪽반응에 원자의 개수를 맞춘다. |
| 4. | 잃은 전자의 숫자와 얻은 전자의 숫자가 같도록 산화 및 환원 반쪽반응에 정수배한다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 76%
|
| 6. | 15℃ 에서 물의 이온화상수 Kw = 0.45 x 10-14 이다. 15℃ 에서 물 속의 H3O+ 의 농도(M)는? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 80%
|
| 7. | 배의 철 표면이 녹스는 것을 방지하기 위하여 종종 마그네슘 판을 붙인다. 이 작업을 하는 이유는? |
| 1. | 마그네슘이 철 보다 더 좋은 산화제이므로 마그네슘이 더 산화되기 쉽다. |
| 2. | 마그네슘이 철 보다 더 좋은 산화제이므로 마그네슘이 더 환원되기 쉽다. |
| 3. | 마그네슘이 철 보다 더 좋은 환원제이므로 마그네슘이 더 산화되기 쉽다. |
| 4. | 마그네슘이 철보다 더 좋은 환원제이기 때문에 마그네슘이 더 환원되기 쉽다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 86%
| | <문제 해설>
녹스는 것 = 산화되는 것
철보다 산화되기 쉬운 금속처리를 하면 철이 산화되는 것을 방지할 수 있음
마그네슘 판을 붙이는 것은 마그네슘을 산화시키기 위함
마그네슘이 산화된다 <-> 철이 환원된다 <-> 철을 마그네슘이 환원시킨다 <-> 마그네슘은 환원제이다
[해설작성자 : 구운감자] |
|
| 8. | 다음 반응식을 참고하여 12.5g CaO 와 75.0g HClO4 의 반응식으로부터 생성되는 Ca(ClO4)2의 g 수를 계산하면? (단, Ca의 원자량은 40.0amu 이며, Cl 의 원자량은 35.5amu 이다.) |
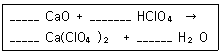
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
먼저 반응식을 완성하면,
1 CaO + 2 HClO4 -> 1 Ca(ClO4)2 + 1 H2O
CaO 분자량 : 40+16=56 , HClO4 분자량 : 1+35.5+16*4=100.5 , Ca(ClO4)2 분자량 : 40+((35.5+16*4)*2)=239
몰수 계산,
CaO = 12.5 / 56 = 0.223 mol , HClO4 = 75.0 / 100.5 = 0.746
하지만, CaO 와 HClO4가 1: 2 반응이므로, HClO4의 몰 수는 0.746/2 = 0.373 이므로 한계시약은 CaO
CaO와 Ca(ClO4)2는 1 : 1 몰이므로 Ca(ClO4)2 의 몰 수는 0.223 mol
Ca(ClO4)2 의 g 수 = 몰 수 * 분자량 = 0.223 * 239 = 53.297 g
[해설작성자 : 제로보이] |
|
| 9. | 다음 표의 (ㄱ), (ㄴ), 그리고 (ㄷ)에 들어갈 숫자를 순서대로 나열한 것은? |
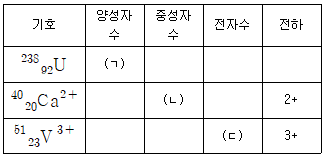
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 87%
| | <문제 해설>
ㄱ. 양성자의 수는 원자 번호를 보시면 알 수 있습니다.
ㄴ. 중성자 수는 질량에서 양성자의 수를 빼시면 됩니다.
ㄷ. 전자의 수는 양성자의 수와 같으니 23이지만 3가 양이온이기에 전자 3개가 빠주고 계산하시면 됩니다!
[해설작성자 : 승현] |
|
| 10. | 납 원자 2.55 x 1023 개의 질량은 얼마인가? (단, 납의 몰 질량은 207.2 g/mol 이다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 82%
| | <문제 해설>
1mol = 6.02 x 10^(23)개
납 원자
2.55 x 10(23)개 x (1mol / 6.02 x 10^(23)개) x (207.2g / 1mol)
[Tip : 각각의 단위들을 분모, 분자에 잘 위치시켜 상쇄시켜주면 됩니다]
[해설작성자 : 구운감자] |
|
| 11. | 용접 원료로 사용되는 어떤 화합물이 탄소와 수소만을 포함하고 있다. 이 화합물의 시료 약간을 산소 속에서 완전히 태워 1.69g 의 CO2 와 0.346g 의 물만을 얻었다. 연소 되기 전의 이 화합물의 실험식은 무엇인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 65%
| | <문제 해설>
<반응식> a CxHy + b O2 -> c CO2 + d H20
분자량 : CO2 = 44g/mol , H2O = 18 g/mol
질량 : CO2 = 1.69g , H20 = 0.346g
몰수 : CO2 = 1.69 / 44 = 0.0384 mol , H2O = 0.346 / 18 = 0.0192 mol
0.0384 : 0.0192 = 2 : 1
=> a CxHy + b O2 -> 2 CO2 + 1 H20
우변에 C가 2개, H가 2개 이므로 1:1
=> 좌변 CxHy의 실험식은 CH
∴ 답은 CH (2번)
[해설작성자 : 구운감자] |
|
| 12. | 질소와 수소가 생성되는 암모니아의 반응은 다음과 같다. 이 계가 일정부피의 용기에서 평형에 있다. 만약에 용기의 부피를 감소시키면 어떻게 되는가? |
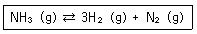
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 76%
| | <문제 해설>
부피가 감소하면 압력이 증가한다.
르 샤틀리에 법칙에 따라 압력이 증가하면 압력을 낮추기 위해 기체의 몰수를 감소시키는 방향으로 평형이 이동한다.
[해설작성자 : 카제로보이] |
|
| 13. | 아지드화나트륨(NaN3)은 박테리아를 죽이기 위하여 가끔 물에 쓰인다. 0.010M NaN3 용액에서 아지드화수소산(HN3)의 농도를 나타내는 식은? (단, HN3의 Ka값은 1.9 x 10-4이고, Kw(=[H+][OH-])는 물의 해리상수이다.) |
| 1. | √ (Kw x 0.01)/(1.9 x 10-4) |
| 3. | √ Kw x 1.9 x 10-4) x 0.01 |
| 4. | √ Kw/1.9 x 10-4) x 0.01 |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 49%
|
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 83%
| | <문제 해설>
분자식은 같으나 결합 구조식이 다른 분자이다.
물리적, 화학적으로 다른 성질을 나타낸다.
[해설작성자 : IS] |
|
| 15. | 어떤 반응의 평형상수를 알아도 예측할 수 없는 것은? |
| 3. | 주어진 초기 농도로부터 도달할 수 있는 평형의 위치 |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 81%
|
| 16. | 7.22g 의 고체 철(몰 질량=55.85)을 산성용액 속에서 완전히 반응시키는데 미지 농도의 KMnO4 용액 187ml 가 필요하였다. KMnO4 용액 의 몰농도(M)는? (단, 이때 미 완결 반응식은 H+ (aq) + Fe(s) + MnO4-(aq) → Fe3+(aq) + Mn2+(aq) + H2O(L) 이다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 31%
|
| 17. | 다음 다원자 이온에 대한 명명 중 옳지 않은 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 81%
| | <문제 해설>
황산이온->아황산 이온
[해설작성자 : 아포] |
|
| 18. | 다음 산화/환원 반응에서 산화되는 물질은 무엇인가? |

정답 : [1]☜ 블럭 설정하면 보임
정답률 : 82%
| | <문제 해설>
전자를 잃는 물질이 산화됨
Br- -> Br 이므로 전자를 잃은 Br-이 산화
[해설작성자 : 구운감자] |
|
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 78%
|
| 20. | 다음 중 불포화 탄화수소에 속하지 않는 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 85%
| | <문제 해설>
포화 탄화수소 - 알칸(=알케인) , 사이클로알케인
불포화 탄화수소 - 알켄 , 알킨(=알카인) , 방향족 탄화수소(=아렌)
[해설작성자 : 구운감자] |
|
| 21. | 염의 용해도에서 0.10M Na2SO4 용액의 이온세기(ionic-strength)는? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 72%
| | <문제 해설>
이온세기 I = 1/2∑(이온 개수 x 이온 몰농도 x 전하2)
Na2SO4 -> 2 Na+ + SO42-
I = 1/2 {( 2 x 0.10M x (1)2) + ( 1 x 0.10M x (-2)2)} = 0.30M
[해설작성자 : 구운감자] |
|
| 22. | 다음 중 화학평형에 대한 설명으로 옳은 것은? |
| 1. | 화학평형상수는 단위가 없으며, 보통 K로 표시하고 K가 1보다 크면 정반응이 유리하다고 정의하며, 이 때 Gibbs 자유에너지는 양의 값을 가진다. |
| 2. | 평형상수는 표준상태에서의 물질의 평형을 나타내는 값으로 항상 양의 값이며, 온도에 관계없이 일정하다. |
| 3. | 평형상수의 크기는 반응속도와는 상관이 없다. 즉 평형상수가 크다고 해서 반응이 빠름을 뜻하지 않는다. |
| 4. | 물질의 용해도 곱(solubility product)은 고체 염이 용액 내에서 녹아 성분 이온으로 나뉘는 반응에 대한 평형상수로 흡열반응은 용해도 곱이 작고, 발열반응은 용해도 곱이 크다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 76%
| | <문제 해설>
1. K값이 크면 정반응 쪽으로 평형이 치우치고, 이 때 Gibbs 자유에너지는 음의 값을 가진다.
2. 평형상수는 온도의 함수이다.
3. 용해곱은 흡열,발열반응과 상관없고, 용해도곱도 평형상수의 일종이므로 온도에 의존한다.
[해설작성자 : comcbt.com 이용자] |
|
| 23. | 역 적정이 EDTA 적정에서도 사용되어 과량의 EDTA를 금속 시료용액에 첨가하고 남아 있는 EDTA를 역적정한다. 이 때 사용되는 역 적정 금속이온으로 가장 적당한 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 67%
| | <문제 해설>
역적정에 사용되는 제 2의 금속 이온이 EDTA 착물로부터 분석물질인 금속 이온을 치환시키면 안된다. 따라서 제 2의 금속 이온은 형성 상수가 작아야 한다.
[해설작성자 : 바밤바] |
|
| 24. | 다음 산화환원 지시약에 대한 설명 중 틀린 것은? |
| 1. | 분석하고자 하는 이온과 결합했을 때 산화된 상태와 환원된 상태의 색이 달라야 한다. |
| 2. | 당량점에서의 전위와 지시약의 표준환원전위(Eo)가 비슷한 것을 사용해야 한다. |
| 3. | 변색범위는 주로 E = Eo + 1/n volt 이다. (단, Eo 는 표준환원전위, n는 전자수이다.) |
| 4. | 지시약은 주로 이중 결합들이 콘주게이션(conjugated) 된 유기물이다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 78%
| | <문제 해설>
변색범위는 주로 E = E°± ( 0.0592 / n ) Volt
[해설작성자 : 구운감자] |
|
| 25. | 특정 화학종이 녹아 있는 수용액의 전위차를 측정하기 위하여 두개의 백금 전극이 아래 그림과 같이 담겨있다. 그림을 옳게 표시한 것은 어느 것인가? |
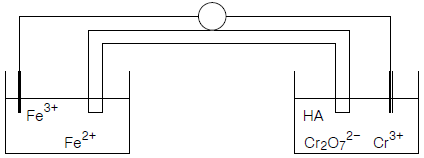 | 1. | Pt(s), Fe2+(aq), Fe3+(aq) : Cr2O72-(aq), Cr3+(aq), HA(aq), Pt(s) |
| 2. | Pt(s) : Fe2+(aq), Fe3+(aq)|Cr2O72-(aq), Cr3+(aq), HA(aq) : Pt(s) |
| 3. | Pt(s)|Fe2+(aq), Fe3+(aq)∥Cr2O72-(aq), Cr3+(aq), HA(aq)|Pt(s) |
| 4. | Pt(s)∥Fe2+(aq), Fe3+(aq)|Cr2O72-(aq), Cr3+(aq), HA(aq)∥Pt(s) |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 81%
|
| 26. | EDTA에 대한 설명 중 옳지 않은 것은? |
| 1. | EDTA 는 이온의 전하와는 상관없이 금속 이온과 강하게 1:1로 결합한다. |
| 2. | EDTA 적정법은 물의 경도를 측정할 때 널리 사용된다. |
| 3. | EDTA 는 Li+, Na+, K+ 와 같은 1가 양이온에만 안정한 착물을 형성한다. |
| 4. | EDTA 적정 시 금속 지시약은 EDTA 보다는 금속이온과 약하게 결합해야 한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 75%
| | <문제 해설>
2가 이상의 금속이온과 1:1의 비율로 결합하여 안정한 구조를 가진다.
1가 금속 양이온과도 착물을 형성하나, 불안정하다.
[해설작성자 : 구운감자] |
|
| 27. | 성분 이온 중 한가지 이상이 용액 중에 들어있는 경우 그 염의 농도가 감소하는 현상을 공통이온 효과라고 한다. 다음 중 공통이온 효과와 가장 관련이 있는 원리[법칙]는? |
| 4. | 르 샤틀리에(Le Chatelier) 원리 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 82%
|
| 28. | 0.1M 금속 Mn+ 용액 50ml를 0.1M EDTA(Ethylene Diamine Tetra-acetic Acid, H4Y)로의 적정과정에 대한 설명 중 올바른 것은? |
| 1. | 당량점 이전의 용액에는 과량의 MYn-4가 남아 있다. |
| 2. | 당량점에서는 [Mn+]=[EDTA]로 이 용액은 MYn-4 를 녹인 용액과는 다른 상태이다. |
| 3. | 당량점 이후에 모든 금속이온은 MYn-4 형태로 존재하며, 이 때 유리 EDTA의 농도는 적정에 첨가한 EDTA의 농도와 같다. |
| 4. | 적정의 종말점 검출방법으로는 금속이온 지시약법, 수은 전극법, pH 전극법, 이온 선택성 전극법 등이 이용된다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 57%
|
| 29. | 다음의 자료를 참조하여 가장 강력한 산화제와 가장 강력한 환원제는 어떤 것인가? |
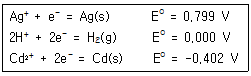 | 1. | 가장 강력한 산화제 : Ag+ , 가장 강력한 환원제 : Ag(s) |
| 2. | 가장 강력한 산화제 : H+ , 가장 강력한 환원제 : H2(g) |
| 3. | 가장 강력한 산화제 : Cd2+ , 가장 강력한 환원제 : Ag(s) |
| 4. | 가장 강력한 산화제 : Ag+ , 가장 강력한 환원제 : Cd(s) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 80%
| | <문제 해설>
표준환원전위 ( standard reduction potentials ) E°
- 물질이 환원되려는 경향의 척도
- 표준환원전위 값이 더 큰 물질이 환원된다.
- E°값이 클수록 환원이 되므로, 반대로 다른 물질을 산화시키기 쉬움. -> 강한 산화제로 작용
=> E°값이 가장 큰 Ag+가 강력한 산화제
=> 반대로 E°값이 가장 작은 Cd가 강력한 환원제
[해설작성자 : 구운감자] |
|
| 30. | 다음 완충용액에 대한 설명 중 옳지 않은 것은? |
| 1. | 완충용액(세기) β는 양수이며, β의 값이 클수록 pH 변화에 더 잘 견딘다. |
| 2. | 완충용액은 pH=pKa (즉, [HA] = [A-])일 때 pH 변화를 막는데 가장 효과적이다. |
| 3. | 완충용액의 pH 는 이온세기와 온도에 의존하지 않는다. |
| 4. | 원하는 pH 에 가장 근접한 pKa 값을 갖는 완충제를 선택해야 한다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 79%
|
| 31. | 다음 농도(Concentration)에 대한 설명 중 옳은 것은? |
| 1. | 몰랄 농도[m]는 온도에 따라 변하지 않는다. |
| 2. | 몰랄 농도는 용액 1Kg 중 용질의 몰수이다. |
| 3. | 몰 농도[M]는 용액 1Kg 중 용질의 몰수이다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 32. | 0.1M 의 과망간산 칼륨이 황산철(II)을 적정하기 위하여 산성용액에서 사용되었다면 과망간산 칼륨의 노르말농도(N)는 얼마인가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 50%
| | <문제 해설>
노르말농도[N] = 몰농도[M] X 당량수(eq/mol)
반응식 : MnO4- + 8H+ + 5e- -> Mn2+ + 4H2O
당량수는 쉽게 말해 1 mol 당 잃거나 얻은 전자의 수
과망간산 칼륨이 전자 4개를 얻었으니 당량수는 5eq/mol
=> 노르말농도 = 0.1(mol/L) X 5(eq/mol) = 0.5 eq/L
[해설작성자 : 구운감자]
과망간산 칼륨이 전자 4개를 얻었으니
전자 4개 -> 전자 5개
[해설작성자 : 구운감자] |
|
| 33. | 산화-환원 적정에서 산화제 자신이 지시약으로 작용하는 산화제는? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 83%
|
| 34. | 다음 산/염기에 대한 설명 중 옳지 않은 것은? |
| 1. | 산은 용액 중에서 H3O+(Hydronium ion) 농도를 증가시키는 물질이며, 염기는 H3O+ 의 농도를 감소시키거나 OH-(수산화 이온)의 농도를 증가시키는 물질이다. |
| 2. | 다 염기성 산은 여러 개의 산 해리상수를 가지며, 해리상수가 클수록 강한 산성을 나타내다. |
| 3. | 순수한 물의 경우 물의 해리상수(pKw=14)로부터 pH를 계산할 수 있다. |
| 4. | 약산의 짝염기는 강한 산으로 완충용액의 제조에 이용된다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 35. | 2,0 mg의 유기물 시료를 연소시켜 4.4mg 의 이산화 탄소(CO2) 기체를 얻었다. 이 유기물 중 탄소(C)의무게 백분율(%)은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 64%
|
| 36. | EDTA 적정에 사용되는 금속이온 지시약으로만 되어 있는 것은? |
| 2. | 페놀프탈레인, EBT(Eriochrome Black T) |
| 3. | EBT(Eriochrome Black T), 크실레놀 오렌지(Xylenol Orange) |
| 4. | 크실레놀 오렌지(Xylenol Orange), 메틸오렌지 |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 70%
|
| 37. | 다음 갈바니 전지의 line diagram에 대한 가장 올바른 설명은? |
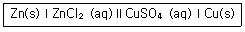 | 2. | 가운데의 두 수직선(∥)은 상 경계(phase boundary)를 의미한다. |
| 3. | 전자는 Zn(s)에서 도선을 따라 Cu(s)으로 흐른다. |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 73%
|
| 38. | 구리이온을 전기석출하기 위하여 0.800A 를 15.2분 동안 유지하였다. 음극에서 석출된 구리의 질량과 양극에서 발생한 산소의 질량을 계산한 것은? (단, 구리 원자량은 63.5g, 산소 원자량은 16.0g 이다.) |
| 1. | 구리(Cu) 질량 = 2.40g, 산소(O2) 질량 = 0.0605g |
| 2. | 구리(Cu) 질량 = 2.40g, 산소(O2) 질량 = 0.605g |
| 3. | 구리(Cu) 질량 = 0.240g, 산소(O2) 질량 = 0.605g |
| 4. | 구리(Cu) 질량 = 0.240g, 산소(O2) 질량 = 0.0605g |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 56%
|
| 39. | 25℃ 0.10M KCl 용액의 계산된 pH 값에 가장 근접한 값은? (단, 0.10M 에서의 H+ 와 OH- 의 활동도 계수는 각각 0.83 과 0.76 이다.) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 64%
|
| 40. | 아세트산의 산 해리 상수가 1.75 x10-5 일 때, pH 6.3의 완충용액을 만들기 위한 아세트산과 아세트산나트륨의 비율(아세트산/아세트산나트륨)은 얼마인가? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 37%
|
| 41. | 몰 흡광계수 (molar absorptivity)가 300M-1cm-1인 0.005M 용액이 1.0cm 시료 용기에서 측정되는 흡광도(absorbance) 및 투광도(transmittance)는? |
| 1. | 흡광도 = 1.5, 투과도 = 0.0316% |
| 2. | 흡광도 = 1.5, 투과도 = 3.16% |
| 4. | 흡광도 = 15, 투과도 = 0.0316% |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 70%
|
| 42. | 분자 흡광도 측정에서 복잡한 스펙트럼을 분해하기 위한 가장 좋은 방법은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 70%
|
| 43. | 다음 중 불꽃 원자흡수분광법이 방출분광법 보다 감도가 더 좋은 이유를 가장 잘 설명한 것은? |
| 1. | 도플러 효과 때문에 흡수선의 선폭이 방출선보다 항상 훨씬 더 넓기 때문 |
| 2. | 보통의 불꽃보다 속빈음극방전등이 복사선 출력이 훨씬 더 크기 때문 |
| 3. | 흡수법에 사용되는 검출기가 방출법에 사용되는 검출기보다 감도가 훨씬 더 좋기 때문 |
| 4. | 불꽃 온도에서 바닥상태 원자의 수가 들뜬상태 원자의 수보다 훨씬 더 많기 때문 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 60%
|
| 44. | 유도결합 플라즈마(ICP) 원자방출 분광법에 사용되는 원자화 방법이 아닌 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 56%
|
| 45. | 원자화 원자분광광도계의 바탕 보정 방법이 아닌 것은? |
| 2. | 자체반전(Smitth-Hieftje) 바탕 보정법 |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 53%
|
| 46. | 다음 화합물 해당원소의 1H 또는 13C NMR 스펙트럼의 봉우리 위치를 올바르게 설명한 것은 무엇인가? |
| 1. | 벤젠의 수소 : 4 ~ 5 ppm 내에서 나타남 |
| 2. | 벤젠의 탄소 : 160 ~ 210 ppm 내에서 나타남 |
| 3. | 아세톤의 수소 : 4 ~ 6 ppm 내에서 나타남 |
| 4. | 아세톤의 카르보닐 탄소 : 190 ~ 220 ppm 내에서 나타남 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 54%
|
| 47. | 다음은 CO2 의 기준진동을 나타낸다. 어느 진동 mode 가 IR spectrum에서는 관측이 되지 않고, Raman Spectrum 에서 관측이 되는가? (단, ○ : 산소, ● : 탄소를 나타낸다.) |
| 1. |  |
| 2. |  |
| 3. |  |
| 4. |  |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 59%
|
| 48. | 1mm 당 1,450개의 홈을 가지고 있는 echellette 회절발에 법선에 대하여 48도의 입사각으로 다색광을 비추었다. 반사각 +10도에서 나타나는 복사선의 1차 반사에 대한 파장(nm)을 계산한 값은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 48%
|
| 49. | Grating(격자)을 이용하여 파장을 분리하는데 이 때 사용되는 빛의 물리적 성질은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 72%
|
| 50. | 다음 중 X-선 형광분광법에서 나타나는 매트릭스(matrix) 효과가 아닌 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 57%
|
| 51. | 유도결합 플라즈마(ICP) 원자방출 분광법은 불꽃/전열화 원자흡수법과 비교하여 여러 가지 장점을 가지고 있다. 다음 설명 중 옳지 않은 것은? |
| 2. | 플라즈마의 높은 온도로 인하여 원소 상호간의 방해가 적다. |
| 3. | 아르곤의 이온화로 분석물의 이온화에 의한 방해가 적다. |
| 4. | 화학적 방해와 매트릭스 효과가 불꽃/전열화 원자흡수법 보다 크다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 64%
|
| 52. | 불꽃 원자흡수 분광법에 의해 식품 중의 칼슘(Ca)을 정량 할 때 스트론튬(Sr)이나 란타넘(La)을 가하는 주된 이유는? |
| 1. | 식품 내의 인산염으로부터의 분광학적인 방해를 줄이기 위해서 |
| 2. | 식품 내의 음이온 특히 인산염으로부터의 화학적 방해를 줄이기 위해 |
| 3. | 스트론튬(Sr)이나 란타넘( La)이 불꽃 중에서 안정한 산화칼슘이 형성되도록 도와주기 위해서 |
| 4. | 식품 내에 존재하는 매트릭스 성분들의 분자가 생성되어 비특정 흡수를 일으키므로, 비특정 흡수를 막기 위해서 |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 63%
|
| 53. | 다음 원자분광법 중 광원이 시료가 아닌 분광법은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 42%
| | <문제 해설>
방출법은 광원을 따로 주지 않고 자신이 가진 고유의 빛으로 복사선을 측정
[해설작성자 : 0_0]
+ 1,2,3은 방출 분광법이다.
[해설작성자 : 0_0] |
|
| 54. | 원자흡수분광법(AAS)에 사용되는 불꽃에 사용되는 가스를 짝지은 것이다. 이 중 사용되지 않는 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 60%
|
| 55. | 다음 광자 변환기(photon detector) 중 자외선 영역에 가장 좋은 감도를 나타내며, 매우 빠른 감응시간을 가지고 있는 것은? |
| 1. | 규소다이오드 검출기(Silicon diode detector) |
| 2. | 광전압전지(photoboltaic cell) |
| 3. | 전하-쌍 장치(charge-coupled device) |
| 4. | 광전증배관(photomultiplier tube) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 56. | 다음 기기분석 장비 중 분자분광을 이용하는 기기가 아닌 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 64%
|
| 57. | 플라즈마 광원의 방출 분광법에는 세 가지 형태의 고온 플라즈마가 있다. 다음 중 여기에 해당하지 않는 것은? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 79%
|
| 58. | 방출 및 화학발광법의 광학분광기기 부분장치 배열방식으로 가장 적당한 것은? |
| 1. | 광원-파장선택기-시료잡이-광전검출기-신호처리장치 |
| 2. | 파장선택기-시료잡이-광원-광전검출기-신호처리장치 |
| 3. | 레이저-시료잡이-파장선택기-광전검출기-신호처리장치 |
| 4. | 광원과 시료잡이-파장선택기-광전검출기-신호처리장치 |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 64%
|
| 59. | 분자흡수분광법과 비교하였을 때 분자발광(luminescence)법의 가장 큰 장점은 무엇인가? |
| 1. | 검출한계는 몇 ppb 정도로 낮은 범위이다. |
| 2. | 모체효과(매트릭스, matrix) 방해가 적다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 59%
|
| 60. | 원자 분광법에서 비소, 안티몬, 주석, 셀레늄 등을 함유한 액체시료를 원자화 장치에 도입할 때 검출 한계를 10 ~ 100배 정도 향상시킬 수 있는 방법은? |
| 1. | 수소화물 발생(Hydride generation) |
| 2. | 레이저 용발(Laser ablation) |
| 3. | 스파아크 용발(Spark ablation) |
| 4. | 클로우 방전(Glow discharge) |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 59%
|
| 61. | 액체 크로마토그래피에서 기울기용리(gradient elution)란 어떤 방법인가? |
| 3. | 2개 이상의 용매(이동상)를 다양한 혼합비로 섞어 사용하는 방법 |
| 4. | 단일 용매(이동상)의 흐름량과 흐름속도를 점차 증가시키는 방법 |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 77%
|
| 62. | 비극성 정지상의 GC에서 다음 세가지 물질 즉, Propanol(끓는점 = 97℃), Butanol(끓는점 = 117℃), Pentanol(끓는점 = 138℃)를 분리했다. 설명이 맞는 것은? |
| 1. | Propanol의 머무름 시간이 가장 짧다. |
| 2. | Butanol의 머무름 시간이 가장 짧다. |
| 3. | Pentanol의 머무름 시간이 가장 짧다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 77%
| | <문제 해설>
알코올에서 탄소 수가 적을수록 극성은 커진다고 하네요
[해설작성자 : comcbt.com 이용자] |
|
| 63. | 이온선택성 전극방법의 특징이 아닌 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 74%
|
| 64. | 액체 크로마토그래피 컬럼의 단수(number of plates) N 만을 변화시켜 분리능(Rs)을 2배로 증가시키기 위해서는 어떻게 하여야 하는가? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 79%
|
| 65. | HCl을 NaOH로 적정 시 conductance의 변화를 바르게 나타낸 것은? (단, Y축은 conductance, X 축은 가한 NaOH의 양이다.) |
| 1. |  |
| 2. |  |
| 3. |  |
| 4. |  |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 76%
|
| 66. | 질량분석법에 기체 상태로 화합물을 이온화 시키는 방법은 전자 충격법과 화학적 이온화법이 많이 이용되고 있다. 이 방법들에 대한 설명 중 옳지 않은 것은? |
| 1. | 전자 충격법은 토막내기 반응이 일어나 분자이온 봉우리를 쉽게 나타낸다. |
| 2. | 전자 충격법은 기화하기 전에 열분해가 일어날 수 있다. |
| 3. | 전자 충격법 스펙트럼보다 화학적 이온화법 스펙트럼이 단순하다. |
| 4. | 화학적 이온화법 스펙트럼은 M+1 과 M-1 봉우리가 나타난다. |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 53%
|
| 67. | 시차주사 열량법(DSC)으로부터 얻을 수 있는 정보가 아닌 것은? |
정답 : [3]☜ 블럭 설정하면 보임
정답률 : 63%
|
| 68. | 전기전도도법을 이용하여 미지의 염산(HCl) 용액을 수산화나트륨(NaOH)으로 적정할 때, 각 이온의 전도도 변화 곡선에 대한 설명 중 틀린 것은? |
| 1. | H3O+에 의한 전도도는 당량점까지 일정하게 감소한다. |
| 2. | OH-에 의한 전도도는 당량점 이후부터 일정하게 증가한다. |
| 3. | Na+에 의한 전도도는 일정하게 증가한다. |
| 4. | Cl-에 의한 전도도는 일정하게 증가한다. |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 61%
|
| 69. | C18 컬럼을 사용하고 메탄올/아세토니트릴 용매를 50:50 비율로 혼합하여 특정 화합물을 분리하려 한다. 이 때 용리 속도가 너무 느려서 빠르게 하는 방법으로 다음 중 가장 적당한 것은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 52%
|
| 70. | 다음 기체-고체 크로마토그래피(GSC)의 가장 기본적인 분리 메커니즘은? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 71. | 다음 중 전위차법에 사용하는 이상적인 기준전극의 조건이 아닌 것은? |
| 1. | 시간이 지나도 일정한 전위를 나타내어야 한다. |
| 3. | 온도가 주기적으로 변해도 과민반응을 나타내지 않아야 한다. |
| 4. | 작은 전류가 흐른 뒤에도 원래의 전위로 되돌아와야 한다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 79%
| | <문제 해설>
반응은 가역적이어야 한다.
[해설작성자 : 낼모레시험] |
|
| 72. | 일반적으로 열분석법은 온도 프로그램으로 가열하면서 물질과 또는 그 반응 생성물의 물리적 성질을 온도함수로 측정하는 분석법이다. 중합체를 시차 열법 분석(DTA)을 통해 분석 할 때 발열반응에서 측정할 수 있는 것은? |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 68%
|
| 73. | 단 높이를 나타내는 van Deemter 식을 올바르게 나타낸 것은? (단, H = 단 높이, A = 다중흐름통로, B = 세로확산, C = 질량이동, u = 이동상의 선형 흐름 속도이다.) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 73%
|
| 74. | 세 전극(기준, 작업, 보조) 전지의 조절 전위 전기분해에 대한 설명 중 옳지 않은 것은? |
| 1. | 작업전극과 기준전극 사이의 전압은 일정 전위기(potentiostat)에 의해서 일정하게 유지된다. |
| 2. | 작업전극과 보조전극 간에는 무시할 수 있을 만큼의 작은 전류가 형성된다. |
| 3. | 세 전극전지를 쓰면 일정한 환원전극 전위 유지 및 전기분해의 선택성을 높일 수 있다. |
| 4. | 기준전극 전위는 저항전위, 농도차 분극, 과 전위의 영향을 받지 않는다. |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 40%
|
| 75. | 전기화학에서 널리 사용되는 포화 카로멜 기준전극의 전극 반응은? |
| 2. | AgCl(s) + e- ↔ Ag(s) + Cl- |
| 3. | Fe(CN)63+ + e- ↔ Fe(CN)64- |
| 4. | Hg2Cl2(s) + 2 e- ↔ 2Hg(L) + 2Cl- |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 54%
|
| 76. | 열무게 분석법(TGA)를 이용하여 시료 CaC2O4ㆍH2O 를 비활성 기체 속에서 5℃/min 상승시키면서 980℃ 까지 온도를 올렸을 때 서모그램 상에 나타나는 수평영역은 여러 칼슘화합물의 안정한 온도영역을 나타낸다. 두 번째 높은 온도(420~660℃)에서 나타나는 수평영역은 어떤 화합물을 나타내는가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 64%
| | <문제 해설>
CaC2O4ㆍH2O -> CaC2O4 -> CaCO3 -> CaO
[해설작성자 : 채채채] |
|
| 77. | 다음 line diagram 의 전지에서 이론적인 전위(V)는? |

정답 : [2]☜ 블럭 설정하면 보임
정답률 : 69%
|
| 78. | 질량 분석계로 분석 할 경우 상대세기(abundance)가 거의 비슷한 두개의 동위원소를 갖는 할로겐 원소는 어느 것인가? |
정답 : [2]☜ 블럭 설정하면 보임
정답률 : 75%
|
| 79. | 질량 분석법에는 질량 분석관이 이온발생원에서 생성된 이온들을 질량/전하 비에 따라 분리를 하게 된다. 질량 분석관으로 주로 사용하지 않는 것은? |
| 1. | 사중극 질량분석관(Quadrupole Analyzer) |
| 2. | 이중 초점 섹터분석계(Double-Focusing Sector Spectrometer) |
| 3. | 비행 시간형 분석계(Time-of-Flight Spectrometer) |
| 4. | 단색화 분석관(Monochromato Spectrometer) |
정답 : [4]☜ 블럭 설정하면 보임
정답률 : 71%
|
| 80. | 질량 분석기로 C2H4+(MW=28.0313)과 CO+(MW=27.9949)의 봉우리를 분리하는데 필요한 분리 능은 약 얼마인가? |
정답 : [1]☜ 블럭 설정하면 보임
정답률 : 67%
|
화학분석기사(구) 필기 기출문제(해설) 및 CBT 2006년09월10일을 이용해 주셔서 감사합니다.
, 필기, 기출문제, 전자문제집, CBT, 온라인, 모의테스트, 모의고사